JACS:Fe催化芳香酮C-H键对烯烃的反马氏加成
自从1993年日本大阪大学的Shinji Murai课题组首次报道了Ru催化邻位C-H键的官能化反应,通过鳌合辅助的C-H键断裂形成C-C键的反应得到了广泛的研究。如今,人们已经发展了许多方法实现C-H键的官能化,但利用廉价的金属催化剂在温和条件下实现选择性的C-H键活化仍旧存在诸多挑战。研究者在探究第四周期过渡金属作为催化剂实现C-H键的官能化的过程中做出来许多努力,但底物的普适性仍旧存在较大的限制。例如,人们利用地壳含量丰富的Fe作为催化剂通过芳香烃的C-H键对化学计量的Fe络合物进行氧化加成实现了以上过程,但催化量Fe催化剂参与的反应少有报道。
1987年,美国罗切斯特大学的William Jones课题组曾经报道了Fe(PMe3)2(CNCH2tBu)作为催化剂,在光引发的条件下实现异氰对芳基C-H键的插入;2008年,日本东京大学的Eiichi Nakamura课题组通过原位生成低氧化态的Fe催化剂实现芳基格氏试剂对芳香烃C-H键的官能化。随后Eiichi Nakamura、Silas Cook和Lutz Ackermann等课题组还发展了Fe催化C-H键烷基化反应。然而到目前为止,只有新加坡南洋理工大学的Naohiko Yoshikai课题组报道了Fe催化C-H键对烯烃的加成反应,他们以NHC配位的Fe作为催化剂,实现了吲哚C2位C-H键对烯烃及炔烃的加成。最近,日本庆应大学的Fumitoshi Kakiuchi教授报道了Fe催化芳香酮C-H键的烷基化反应,他们以简单的Fe(PMe3)4作为催化剂实现了芳香酮对烯烃的反马氏加成。反应对一系列的烯烃具有良好的适用性,烯醇也可作为底物参与芳香酮C-H键的官能化。相关工作发表在J. Am. Chem. Soc. 上。

图1. 烯烃对芳香酮的C-H键官能化。图片来源:J. Am. Chem. Soc.
作者使用苯基新戊酮1a与三乙基乙烯基硅烷2a作为底物、10 mol%的Fe(PMe3)4 作为催化剂,反应在THF溶剂中70 ℃条件下反应,可以91%的NMR收率得到邻位C-H单官能团化的产物4aa(eq 1);使用1,4-二氧六环、甲苯或正己烷作为溶剂均得到类似的结果,不使用溶剂时反应的产率也可以达到93%。
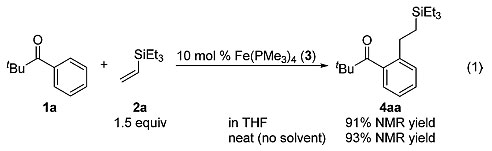
图2. C-H键烷基化反应的初步考察。图片来源:J. Am. Chem. Soc.
得到最优条件之后,他们对底物的普适性进行了考察。首先考察苯基新戊酮1a与不同取代基修饰的烯基硅烷的反应情况,不同底物参与反应都能够以优秀的收率得到目标产物(4ab-4ad)。随后他们固定三乙基乙烯基硅烷2a,考察不同芳香酮对反应的影响。二级烷基芳香酮底物能以中等至良好的收率参与反应(4ba-4ca),但是乙酰丙酮无法发生反应;苯基新戊酮1a对位含有OMe、Me、F、CF3取代基的底物也能以优秀的收率得到目标产物(4ca-4ga);间位含有Me、CF3取代基的底物也能够在位阻较小的一侧顺利地发生反应。
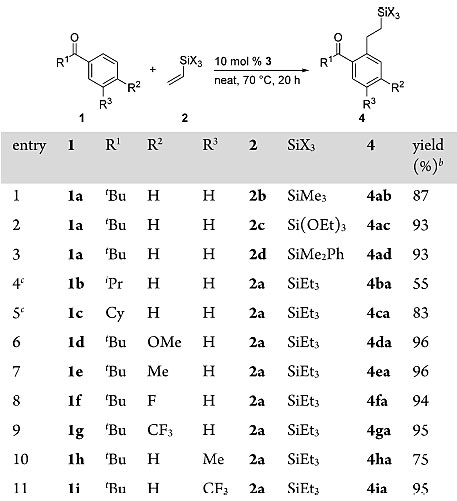
图3. 底物的适用性考察。图片来源:J. Am. Chem. Soc.
除此之外,二苯甲酮5a和邻位甲基取代的二苯甲酮5b、5c仅能以20-30%的较低收率得到产物6aa-6ca(eq 2),但当其对位引入甲基或甲氧基时会显著提高反应活性,最终可以高选择性地得到多组C-H键官能化的产物8da-8ea(eq 3)。
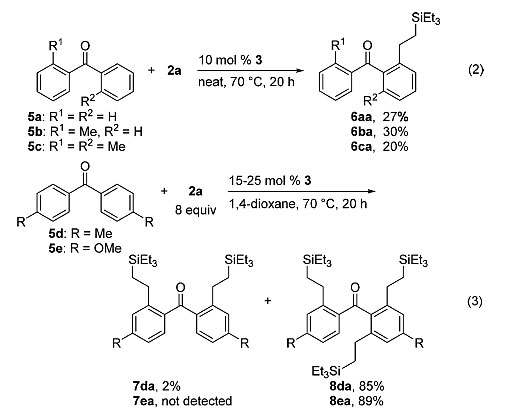
图4. 二芳基酮底物的适用性考察。图片来源:J. Am. Chem. Soc.
接下来,他们对芳香环状酮9的底物普适性也进行了考察。α-四氢萘酮无法反应,2,2-二甲基-1-四氢萘酮使用5 mol %的3作为催化剂可以得到96%的目标产物(entry 1);2,2-二甲基-1-茚满酮使用10 mol %的3作为催化剂产率只有28%,当催化剂的负载量提高到20 mol %,产率可提升至40%(entries 2-3);苯并环庚烯酮衍生物参与反应能以56%的收率得到C-H键官能化的产物(entry 4);使用其他乙烯基硅烷作为底物反应也可以顺利地进行(entries 5-7)。硅基取代基换成烷基或芳香基时,反应也能得到中等到优秀的收率(entries 8-16),并且烷基取代基部分含有硅基、环己基、环己烯基修饰时也具有良好的兼容性。苯乙烯类底物参与反应时主要得到反马氏加成的产物。

图5. 芳香环状酮与不同烯烃反应的底物适用性。图片来源:J. Am. Chem. Soc.
随后,他们将烯基硅烷底物换作烯基醚或者烯基胺衍生物,反应能以中等至良好的收率得到C-H键官能化的产物。9a与正丁基乙烯基醚在70 ℃的条件下反应20 h,产物的收率仅为31%;温度降低至50℃时反应40 h,收率可以提高至58%(16aa);大位阻的烯醇表现出更高的反应活性,可以80%-97% 得到目标产物(16ac-16af);苄基取代的烯醇参与反应也能得到中等至良好收率(16ag-16ah);含有氮原子的乙烯基咔唑能以98%的优秀收率发生反应(18aa)。
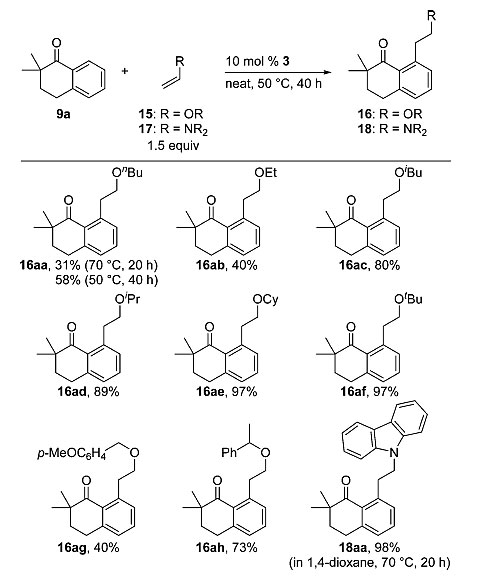
图6. 烯基醚或者烯基胺底物的普适性考察。图片来源:J. Am. Chem. Soc.
最后,他们对反应的催化机理进行了研究,使用同位素氘取代的1a-d5与2a在70 ℃条件下反应5 min,通过1H NMR与2H NMR表征可以发现苯基新戊酮邻位和乙烯基硅烷α-位的H(=CH-SiEt3)发生了部分交换,烷基化产物的NMR表征表明反应仅在三乙基硅基取代基的α-位(CH2-SiEt3)发生了氘代。以上实验说明了C-H键断裂并非反应的决速步,并且中间体A-F之间存在着平衡。机理实验暗示了中间体E在氢化金属化过程中更容易形成线性中间体F,而非支链中间体G,这种线性选择性与氢化金属化过程本身的高选择性相关,而与F或者G的选择性还原消除无关。
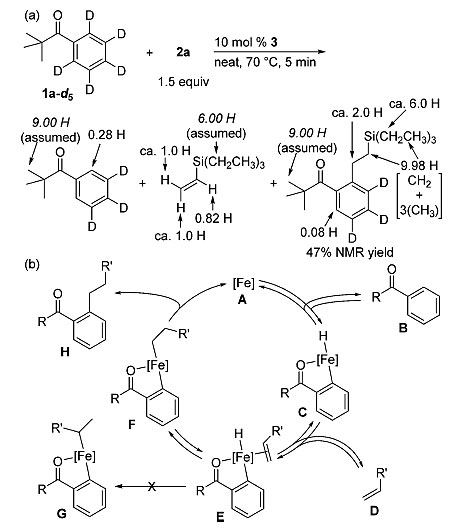
图7. 反应机理的研究。图片来源:J. Am. Chem. Soc.
小结
Fumitoshi Kakiuchi课题组报道了Fe(PMe3)4催化芳香酮C-H键对烯烃的反马氏加成反应,该反应对于一系列乙烯基硅烷、脂肪族末端烯烃、苯乙烯、烯基醚、烯基胺等底物均具有良好的适用性。作者通过同位素氘代实验发现C-H键的断裂并非决速步,并且1a-d5邻位的C-D键可以和烯烃α-位的H发生部分H/D交换。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iron-Catalyzed Regioselective Anti-Markovnikov Addition of C−H Bonds in Aromatic Ketones to Alkenes
J. Am. Chem. Soc., 2017, 139, 14849, DOI: 10.1021/jacs.7b08385
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号