若氟被这世界温柔相待:Science报道氟代芳香烃的不脱氟高效氢化
氟在所有与碳原子成键的原子中范德华半径仅大于氢(rH = 1.20 Å, rF = 1.47 Å)。根据Linus Pauling提出的电负性概念,氟是元素周期表中电负性最大的元素(χp = 3.98)。基于这两种特性,C-F键发生高度极化,离子键成分加强,因而具有很强的键能,致使含氟化合物相比于非氟母体常常表现出特殊的性质。与此同时,C-F键具有很强的偶极矩,调控含氟化合物中几个C-F键的相对取向可以得到高极性的分子,进而用于液晶介电材料的设计。
英国圣安德鲁斯大学的David O'Hagan教授团队曾尝试合成一系列包含多组邻位单氟亚甲基(~[CHF]n~, n = 3-6)单元的直链烷烃,并分别对其构象进行研究。他们发现其中的全顺式氟代烷烃异构体倾向于形成螺旋式构象,可避免1,3-C-F键重叠产生静电排斥。与此同时,受到氟原子邻位交叉效应的影响,1,2-C-F键以邻位交叉式构象排列,导致分子中不同C-F键产生的偶极发生一定的抵消。为了最大程度地得到高极性的氟代烷烃分子,David O'Hagan教授设想利用环烷烃本身存在的刚性作用来束缚1,3-C-F键的相对取向,于2011年首次报道了全顺式1,2,3,4-四氟环己烷的合成,并通过低温核磁共振波谱测定氟原子间的空间偶合作用及X射线单晶衍射结构表征确定了2,4位的C-F键呈重叠式。该工作以1,3-环己二烯为原料,经臭氧氧化及后续的氟化过程最终得到目标产物,理论计算预测该分子的偶极矩为4.91 D。随后,他们还相继报道了全顺式1,2,4,5-四氟环己烷和1,2,3,4,5,6-六氟环己烷的合成,其中全顺式1,2,3,4,5,6-六氟环己烷的偶极矩高达6.2 D(点击阅读相关)。
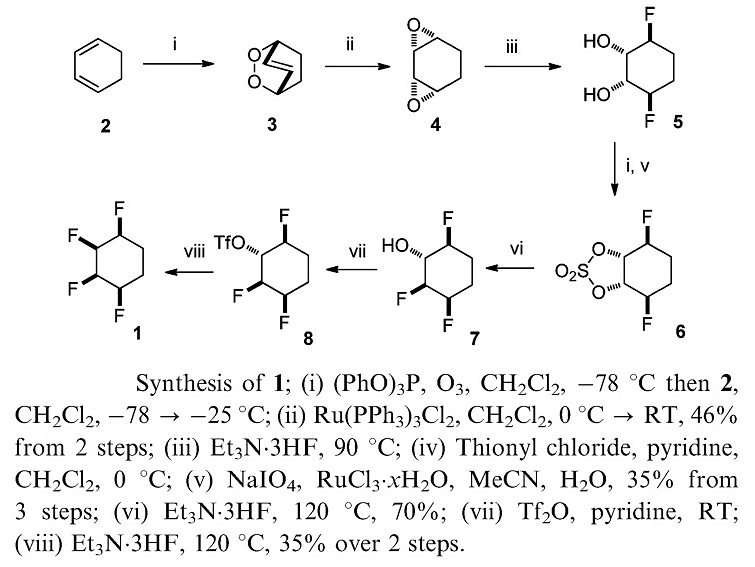
图1. 全顺式1,2,3,4-四氟环己烷的合成。图片来源:Chem. Commun., 2011, 47, 8265
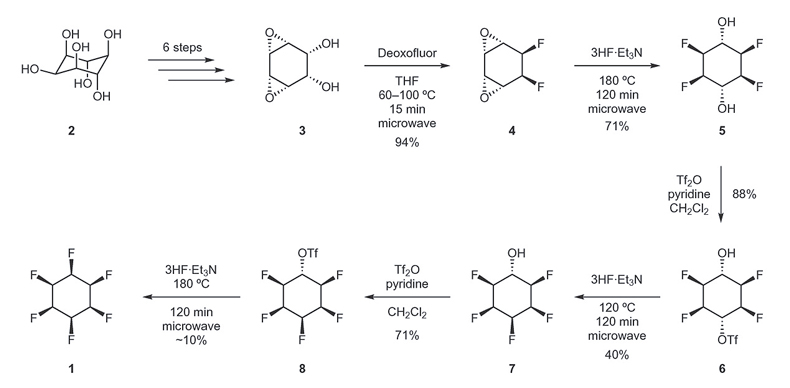
图2. 全顺式1,2,3,4,5,6-六氟环己烷的合成。图片来源:Nat. Chem., 2015, 7, 483
然而纵观David O'Hagan教授发展的合成方法,反应从肌醇出发需经历12步线性合成,其中需要多次借助微波反应实现氟化过程,且第10、12步产率较低,严重影响了1,2,3,4,5,6-六氟环己烷的合成效率。如需将这种分子用于介电材料的研究,设计一种简洁有效的途径简化该化合物的制备过程并提高其合成效率势在必行。最近,德国明斯特大学的Frank Glorius教授团队结合铑催化剂与环(烷基)(氨基)卡宾(CAAC)配体,发展了一种氟代芳香烃催化氢化的方法高效合成氟代环己烷。该反应甚至还能通过一步简单的催化过程实现不同多氟取代环己烷的大规模制备,同时以六氟苯为原料实现了全顺式1,2,3,4,5,6-六氟环己烷的合成。相关工作发表在Science 上,文章的第一作者为Mario Wiesenfeldt。

图3. 铑催化剂参与的氟代芳香烃的催化氢化。图片来源:Science
尽管目前人们发展了多种氟化的方法制备氟代环烷烃,大多数的自由基氟化过程主要得到反式异构的多氟取代产物,与此同时反应的选择性较差,常伴随着过度氟化的发生,因而需要通过立体选择性的亲核氟化过程实现全顺式氟化。然而氟负离子的亲核性弱、碱性较强,以亲核取代的途径引入氟原子时反应条件相对剧烈,并可能发生消除等其他副反应。Frank Glorius教授在钌催化剂结合N-杂环卡宾(NHC)配体实现(杂)芳香烃立体选择性的催化氢化反应中积累了丰富的经验,利用该类方法最终可以得到高选择性的顺式氢化产物。于是他们设想从氟代芳香烃出发,通过催化氢化来合成氟代环烷烃。
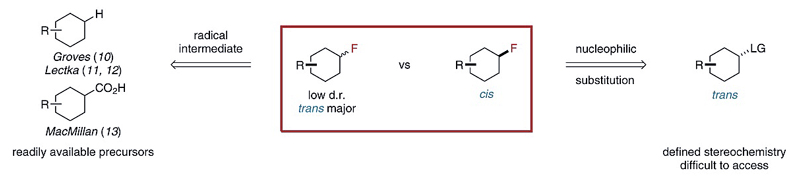
图4. 传统的自由基氟化与亲核氟化反应用于环烷烃的氟化。图片来源:Science
作者首先以叔丁基(4-氟苯氧基)二甲基硅烷(3a)作为模板底物进行尝试,以往发展的芳香烃氢化体系伴随着脱氟的竞争过程,反应仅有痕量的目标产物生成。2015年,西安交通大学的曾小明教授报道了铑催化剂与CAAC配体结合,选择性地将芳基酮去芳构化转化为相应的脂肪酮化合物,反应中使用的CAAC配体具有很强的σ给电子能力,可通过提高金属中心d轨道的电子对芳香烃π*反键轨道的反馈增强两者间的相互作用,芳基发生选择性氢化,与此同时酮羰基不受到影响。Frank Glorius教授等人将该催化体系引入氟代芳香烃的氢化反应中,并逐步降低溶剂的极性抑制底物脱氟的副反应发生。最终他们使用正己烷作为溶剂,能以95%的产率高选择性地得到氢化产物7a,反应中催化剂的负载量仅为0.1 mol%,7a与6a的比例为53:1。
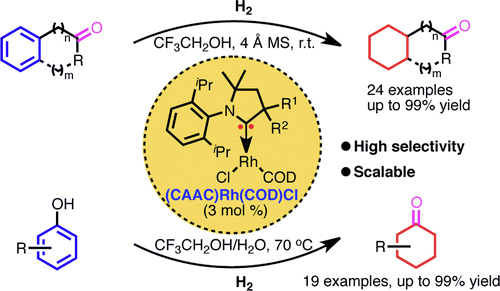
图5. 曾小明教授发展的芳基酮选择性去芳构化反应。图片来源:J. Am. Chem. Soc., 2015, 137, 9250
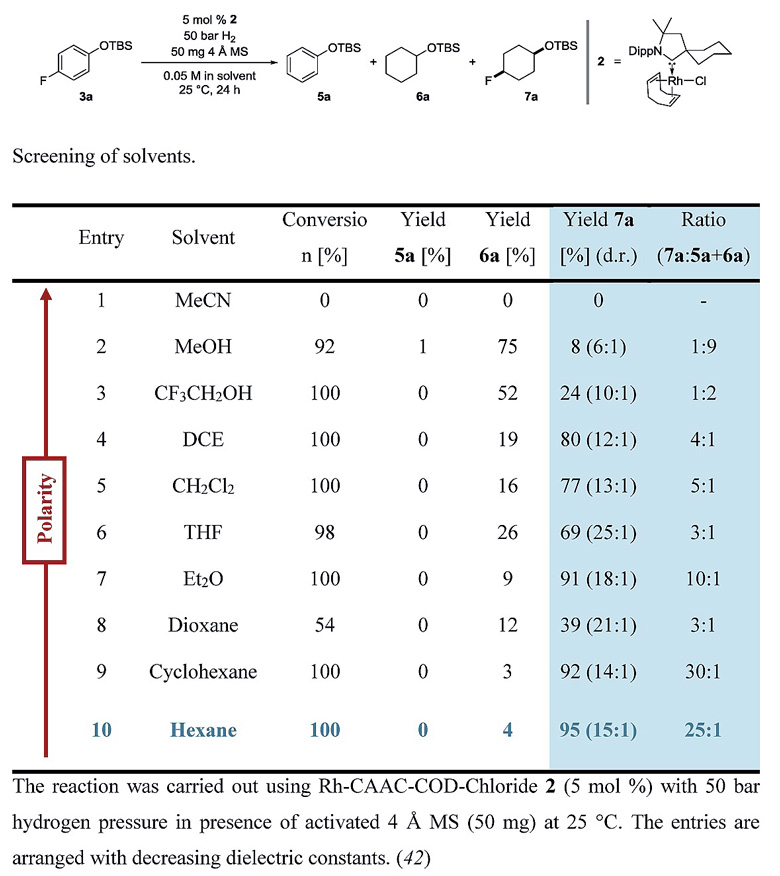
图6. 不同溶剂对反应结果的影响。图片来源:Science
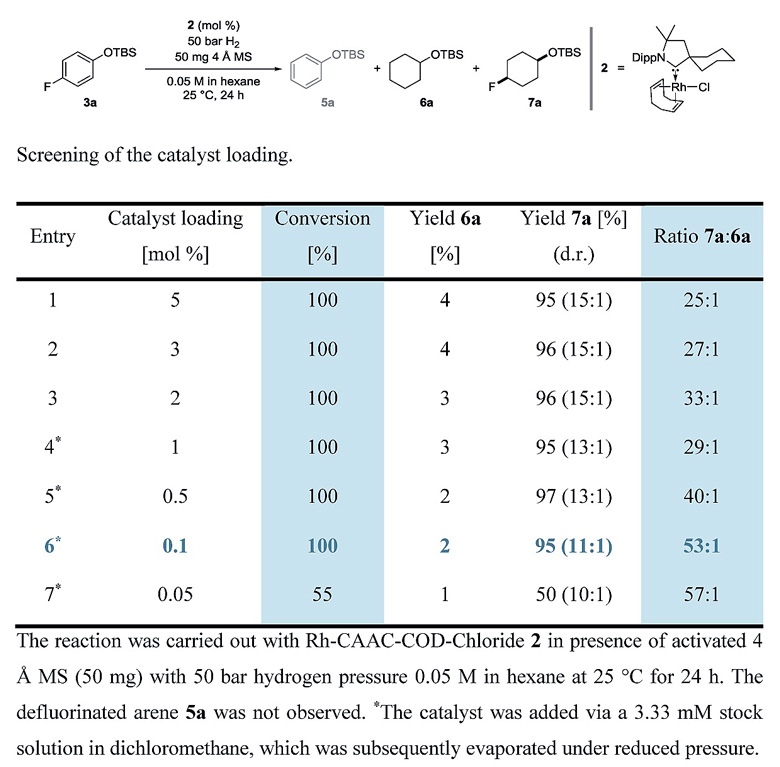
图7. 不同催化剂负载量对反应结果的影响。图片来源:Science
Frank Glorius教授团队首先选择一系列简单的氟代芳香烃对底物的适用范围进行考察,反应对单氟及多氟取代的芳香烃都具有很好的适用性,可实现克级规模的合成,不同官能团取代的芳香烃均可以很好地兼容。产物经过柱层析或重结晶纯化可得到单一构型的非对映异构体,其顺式选择性可通过NOE(Nuclear Overhauser Effect)实验或X射线单晶衍射实验加以证实。除此之外,他们还利用该氢化反应分别一步制备了全顺式的1,2,3,4-四氟环己烷、1,2,4,5-四氟环己烷及1,2,3,4,5,6-六氟环己烷,合成路线与反应效率得到了大幅度优化,为进一步将这些分子用于液晶材料的研究奠定了基础。
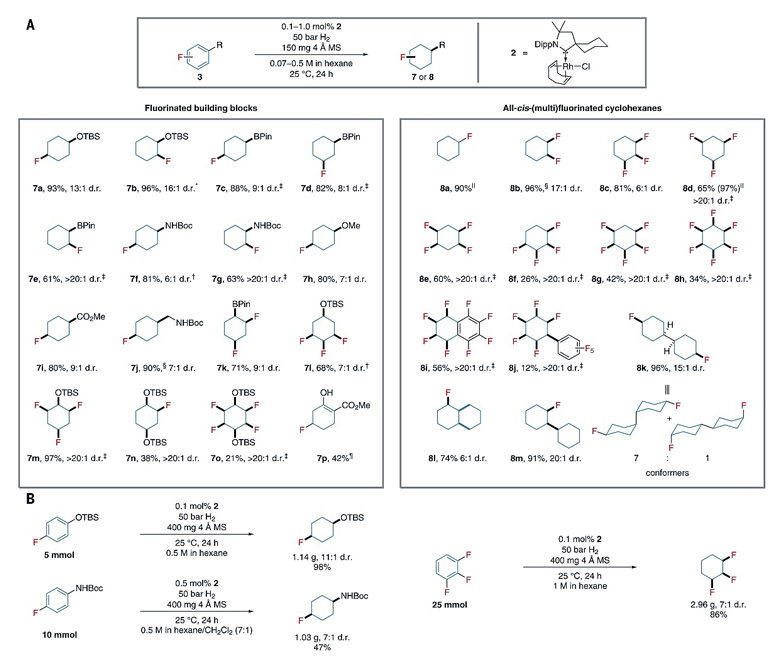
图8. 氟代芳香烃催化氢化的底物普适性考察。图片来源:Science
作者还将底物拓展到氟代杂环芳香烃及其他含氟复杂生物活性分子,与此同时还对产物7f、7l进行后续衍生化顺利得到多种含氟药物。
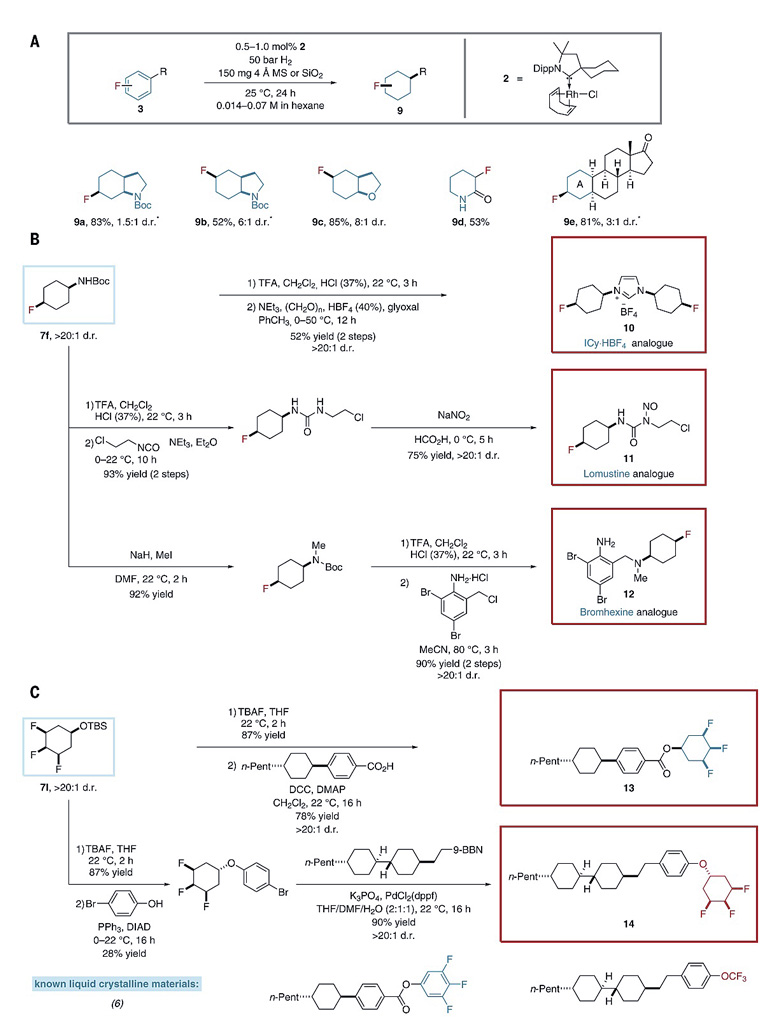
图9. 氟代芳香烃催化氢化底物的进一步拓展及应用。图片来源:Science
——总结——
Frank Glorius教授团队设计了一种温和高效的催化体系实现氟代芳香烃的高选择性氢化,反应在得到全顺式氟代环烷烃的同时有效抑制了脱氟竞争过程,并具有很好的底物普适性,对相关材料的研究及药物的大规模合成具有重要的实际意义。目前他们正在研究不同溶剂对催化体系产生影响的作用机制,以期更深入地理解反应中伴随的脱氟竞争过程,从而进一步优化该氢化反应。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Hydrogenation of fluoroarenes: Direct access to all-cis-(multi)fluorinated cycloalkanes
Science, 2017, 357, 908, DOI: 10.1126/science.aao0270
参考资料:
https://phys.org/news/2017-08-method-formation-fluorinated-molecular.html
(本文由夜若岚尘供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!











































 京公网安备 11010802027423号
京公网安备 11010802027423号