暨南大学药学院团队:周细胞靶向前药克服血管破坏剂的治疗耐受
靶向肿瘤血管是一种有效治疗肿瘤的方案。血管破坏剂通过损伤肿瘤血管的内皮细胞,从而特异性破坏肿瘤血管,导致肿瘤中心大面积坏死,在临床试验中发挥了良好的抗肿瘤疗效。然而,血管破坏剂不能破坏肿瘤边缘区域的血管,因此治疗后会在肿瘤边缘组织残留明显的“生存圈”,导致肿瘤的复发和转移。多年来,人们一直尝试使用血管破坏剂和放化疗药物联合用药等方法来消除“生存圈”,但效果不理想。
肿瘤血管主要由血管内皮细胞和周细胞组成。周细胞覆盖于内皮细胞形成管腔外壁,通过直接接触和旁分泌信号与内皮细胞进行细胞通讯,在维持血管稳定性中扮演着至关重要的角色。此外,肿瘤边缘组织血管周细胞覆盖率较高,这可能是导致肿瘤边缘组织血管对血管破坏剂耐受的重要原因之一。然而,目前尚无通过靶向周细胞破坏肿瘤血管的相关报道。基于此,暨南大学药学院的叶文才教授(点击查看介绍)、张冬梅教授(点击查看介绍)与陈河如教授(点击查看介绍)团队提出靶向肿瘤血管周细胞来破坏肿瘤血管和“生存圈”这一设想。为了靶向肿瘤血管周细胞,该团队利用FAPα酶选择性高表达于肿瘤血管周细胞的这一特性,以长春碱衍生物DAVLBH(一种血管破坏剂)为母药设计并合成了FAPα酶激活式长春碱前药Z-GP-DAVLBH。Z-GP-DAVLBH可特异性被肿瘤血管周细胞表达的FAPα酶水解,从而诱导肿瘤血管周细胞收缩、脱落,引起肿瘤中心及边缘的血管破裂,导致整个肿瘤组织缺血缺氧而坏死。该研究首次阐明了靶向肿瘤周细胞是一种既可破坏肿瘤血管,又可有效克服肿瘤治疗耐受的全新治疗策略。研究结果发表在国际著名学术期刊The Journal of Clinical Investigation 上。

首先,作者构建了MDA-MB-231乳腺癌裸鼠移植瘤模型,利用免疫荧光、免疫组化、透射电镜和内皮细胞-周细胞3D共培养的方法测定了母药DAVLBH的血管破坏作用,发现DAVLBH可诱导肿瘤中心区域血管内皮细胞收缩、脱落而破坏血管,但对肿瘤边缘组织周细胞覆盖率较高的血管不敏感,以至于DAVLBH治疗后残留“生存圈”。这进一步证实了周细胞可能是肿瘤对血管破坏剂治疗耐受的重要原因。
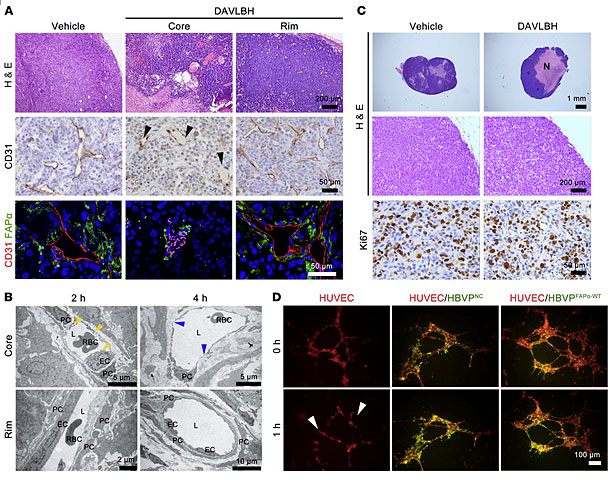
图1. DAVLBH对肿瘤边缘组织血管不敏感。图片来源:J. Clin. Invest.
随后,作者利用重组人FAPα酶、构建FAPα过表达的周细胞和MDA-MB-231裸鼠移植瘤来测定FAPα酶对Z-GP-DAVLBH的选择性水解。结果显示,Z-GP-DAVLBH可被FAPα特异性水解,在肿瘤组织内可迅速释放出母药DAVLBH。另外,Z-GP-DAVLBH可选择性破坏FAPα+周细胞,而对肿瘤细胞、内皮细胞和FAPα-周细胞的细胞骨架无明显影响。
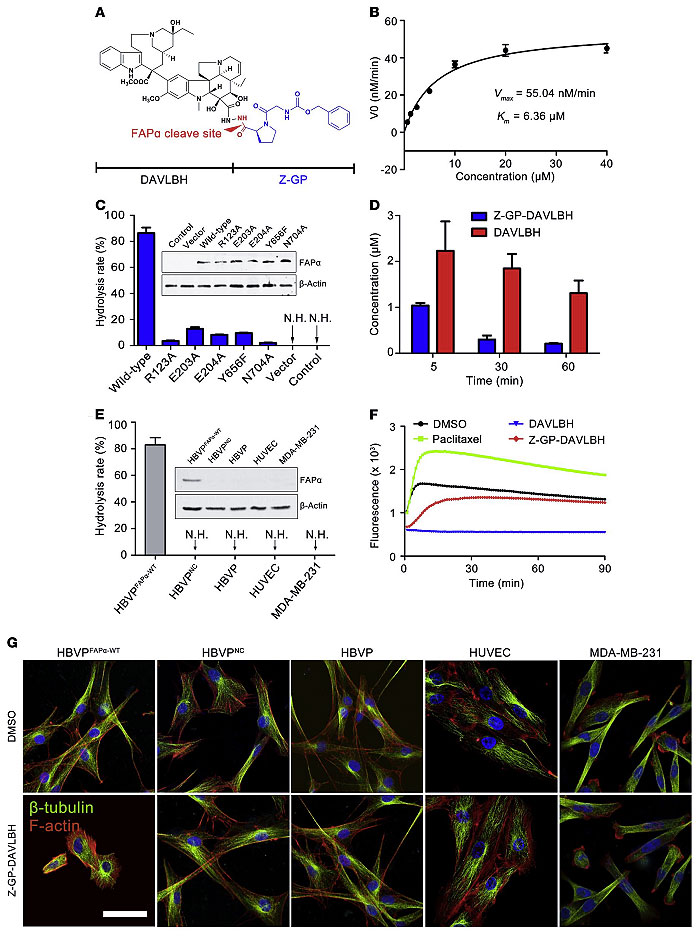
图2. Z-GP-DAVLBH可特异性被FAPα水解并选择性破坏周细胞骨架。图片来源:J. Clin. Invest.
作者进一步用内皮细胞-周细胞3D共培养体系测定Z-GP-DAVLBH的体外血管破坏作用。为了观察Z-GP-DAVLBH对内皮细胞和周细胞的选择性,他们构建了Z-GP-DAVLBH-BODIPY荧光探针。实验结果显示,Z-GP-DAVLBH可特异性累积在3D共培养体系的FAPα+周细胞内,从而选择性诱导FAPα+周细胞变圆,最终破坏内皮细胞-FAPα+周细胞3D共培养管腔。
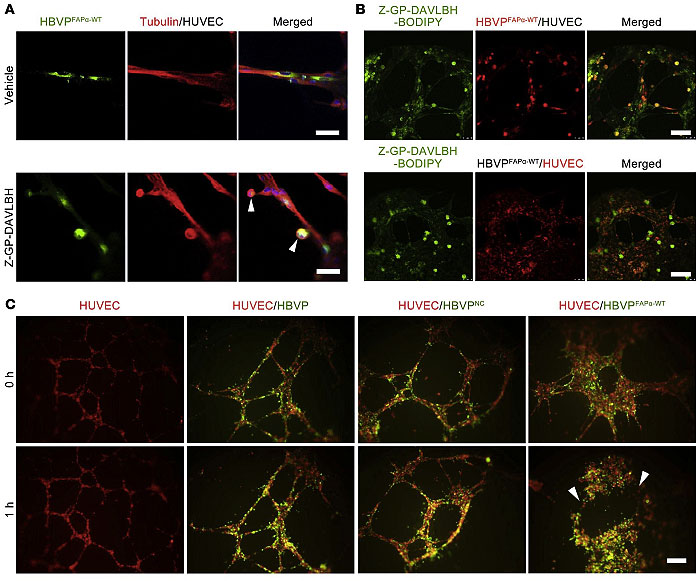
图3. Z-GP-DAVLBH靶向周细胞破坏内皮细胞-周细胞3D共培养管腔。图片来源:J. Clin. Invest.
作者利用MDA-MB-231乳腺癌裸鼠移植瘤模型测定Z-GP-DAVLBH的体内血管破坏作用。免疫组化、免疫荧光和透射电镜结果表明,Z-GP-DAVLBH可同时诱导肿瘤中心和边缘区域血管FAPα+周细胞脱离管腔,最终破坏肿瘤血管。由此证明Z-GP-DAVLBH可通过靶向周细胞破坏肿瘤血管。
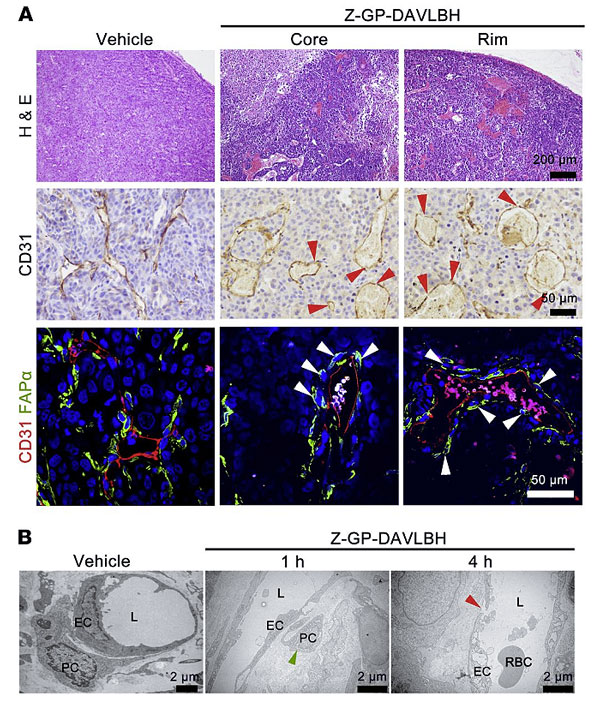
图4. Z-GP-DAVLBH靶向周细胞破坏肿瘤血管。图片来源:J. Clin. Invest.
作者采用磁共振在体监测Z-GP-DVLBH对MDA-MB-231乳腺癌裸鼠移植瘤的血管破坏和抗肿瘤作用。结果显示,Z-GP-DAVLBH可同时持续降低肿瘤中心和边缘区域的血流灌注量(Ktrans 值下降),诱导肿瘤中心和边缘区域坏死(ADC值升高)。H&E和免疫组化验证了磁共振的检测结果,Z-GP-DAVLBH治疗后,可迅速引起肿瘤中心和边缘区域肿瘤细胞凋亡、血管破裂、血管内容物泄漏至肿瘤实质,最终引起血管密度下降、肿瘤组织整体坏死,无“生存圈”残留。
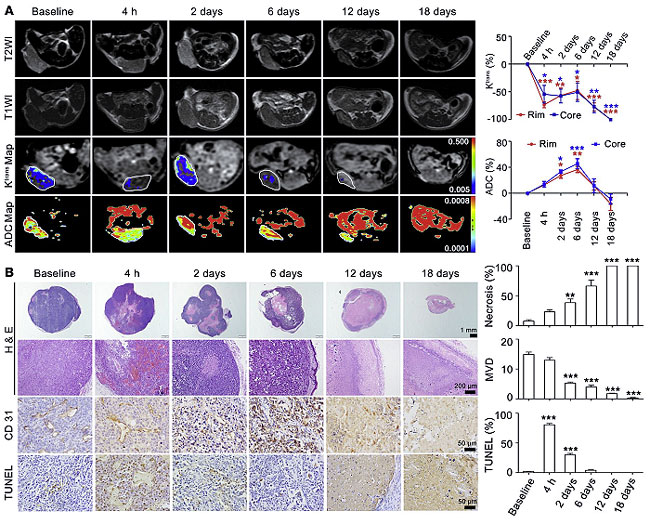
图5. 磁共振检测Z-GP-DAVLBH对肿瘤血管的破坏作用。图片来源:J. Clin. Invest.
作者构建了乳腺癌MDA-MB-231、肝癌HepG2、肺癌A549、宫颈癌HeLa、鼻咽癌CNE-2、乳腺癌PDX(patient-derived xenograft)和肝癌PDX模型来测定Z-GP-DAVLBH的抗肿瘤活性。结果表明,Z-GP-DAVLBH可诱导上述FAPα+移植瘤模型萎缩甚至消失。此外,Z-GP-DAVLBH也可诱导体积为750-2500 mm3 的大瘤径移植瘤萎缩。
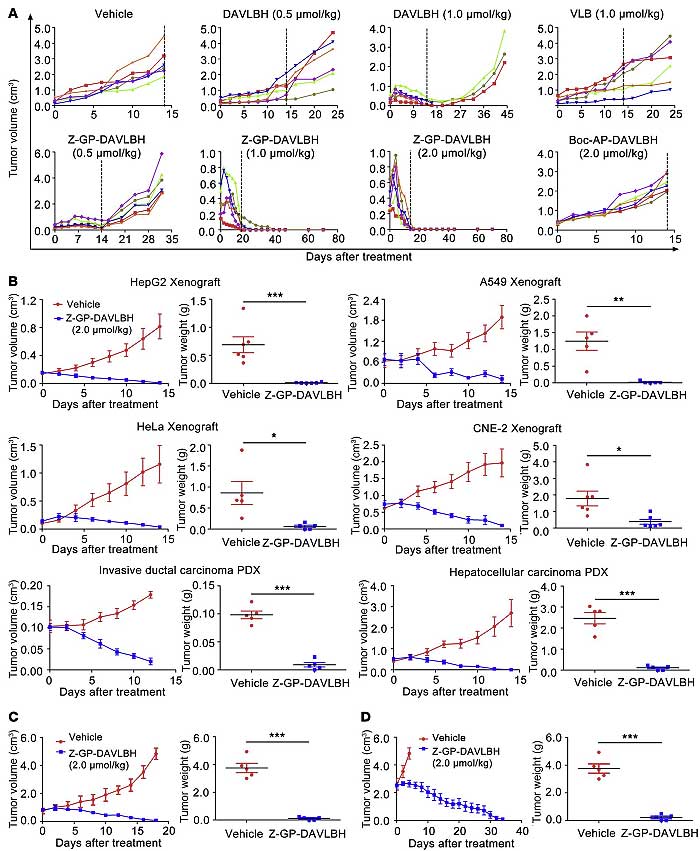
图6. Z-GP-DAVLBH具有广谱抗肿瘤活性。图片来源:J. Clin. Invest.
作者利用MDA-MB-231乳腺癌移植瘤裸鼠评价了Z-GP-DAVLBH的体内毒副作用。结果表明,Z-GP-DAVLBH在治疗剂量下对荷瘤裸鼠的毒副作用比DAVLBH和长春碱低,对外周血白细胞计数影响较小,对心、肝、脾、肺、肾和骨髓等脏器组织无明显损伤。
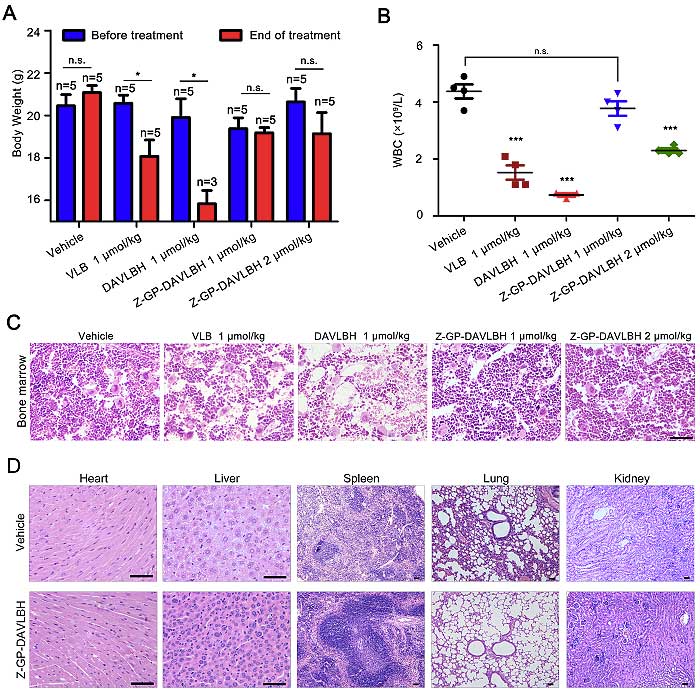
图7. Z-GP-DAVLBH的毒副作用较低。图片来源:J. Clin. Invest.
总结:叶文才、张冬梅与陈河如团队首次阐明了利用FAPα酶激活式长春碱类前药靶向肿瘤周细胞是一种全新的破坏肿瘤血管的策略,可有效克服肿瘤对血管破坏剂的治疗耐受。作为第一个靶向周细胞的肿瘤血管破坏剂类候选药物,Z-GP-DAVLBH具有较低的毒性和良好的抗肿瘤活性以及广阔的新药开发前景,有望用于FAPα+实体恶性肿瘤的临床治疗。目前,该团队正在进行新药申报的临床前研究。
该论文作者为:Minfeng Chen, Xueping Lei, Changzheng Shi, Maohua Huang, Xiaobo Li, Baojian Wu, Zhengqiu Li, Weili Han, Bin Du, Jianyang Hu, Qiulin Nie, Weiqian Mai, Nan Ma, Nanhui Xu, Xinyi Zhang, Chunlin Fan, Aihua Hong, Minghan Xia, Liangping Luo, Ande Ma, Hongsheng Li, Qiang Yu, Heru Chen, Dongmei Zhang and Wencai Ye
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Pericyte-targeting prodrug overcomes tumor resistance to vascular disrupting agents
J. Clin. Invest., 2017, DOI: 10.1172/JCI94258
导师介绍
叶文才
http://www.x-mol.com/university/faculty/27115
张冬梅
http://www.x-mol.com/university/faculty/27118
陈河如
http://www.x-mol.com/university/faculty/27092
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号