靶向癌细胞下调靶点新策略:酶催化组装与解组装
癌症是仅次于心血管疾病导致人类死亡的第二大疾病。化疗是治疗癌症并延长病人生存期的常用手段,但化疗药物的耐药性大大限制了药物的使用。为了解决耐药性问题,科学家采取靶向治疗手段抑制耐药转运蛋白的活性以及药物联合使用等方法。虽然这些新的策略取得了一定的效果,但并没有从根本上解决问题,而且病人的生存期并没有统计学意义的差别。因此研发能够同时靶向多个癌症标志特征的新方法迫在眉睫。然而,由于致癌突变位点数量很多(大于100000),具有多于350个突变位点影响癌症的表型,因此同时靶向多个平行的位点是巨大的挑战。即使可以做到以上要求,许多癌症细胞和正常细胞共用信号通路,也会引起很大的副作用。另外,某些基因的突变将导致癌症下调或抑制其他基因(抑癌基因)的表达,这就增加了设计靶向下调基因或蛋白的困难。
最近,布兰迪斯大学的徐兵教授(点击查看介绍)课题组通过酶催化诱导小分子多肽特异性地在细胞表面或者细胞内自组装,在选择性杀死癌细胞方面取得了更大的进展。研究人员设计了如下三肽衍生物前体1-OMe-OP,该分子中的磷酸酪氨酸残基为碱性磷酸酶(ALP)底物,而羟基甲酯则是羧酸酯酶(CES)的底物。ALP将前体1-OMe-OP去磷酸化生成1-OMe-OH,CES催化甲酯水解生成1-OH-OP,而前体在这两种酶的共同作用下转换成1-OH-OH。
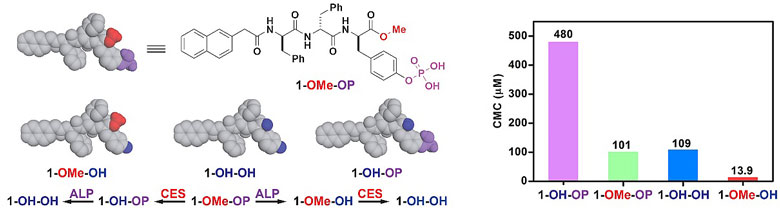
自组装能力顺序为1-OMe-OH > 1-OMe-OP > 1-OH-OH > 1-OH-OP,所以去磷酸化反应会增强体系的自组装能力,产生有细胞毒性的组装体;而CES的作用将大大降低体系自组装的能力,使其解组装生成无细胞毒性的单体。因此,前体1-OMe-OP只能选择性抑制表达ALP而下调表达CES的癌细胞,如高分化浆液性卵巢癌细胞(OVSAHO),而对表达ALP但上调表达CES的癌细胞,CES的作用使细胞表面组装体解组装,导致对这类细胞(如HepG2)无毒性。由于正常肝细胞也大量表达水解酶(如CES),这一策略可用于降低化疗药物的肝毒性。
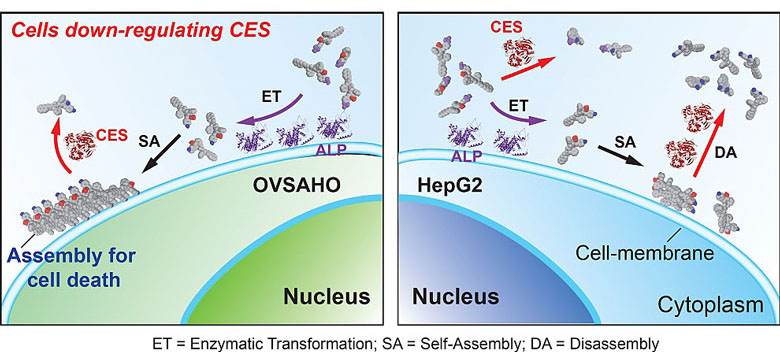
该工作不仅展示了靶向癌细胞中下调靶点的新方法,还提供了根据数据库蛋白表达谱预测治疗可能的新思路。相关工作发表在Journal of the American Chemical Society 上。
该论文作者为:Zhaoqianqi Feng, Huaimin Wang , Rong Zhou, Jie Li, and Bing Xu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzyme-Instructed Assembly and Disassembly Processes for Targeting Downregulation in Cancer Cells
J. Am. Chem. Soc., 2017, 139, 3950, DOI: 10.1021/jacs.7b00070
徐兵博士简介

徐兵,美国布兰迪斯大学化学系教授,1996年于宾夕法尼亚大学取得博士学位,1996至1997年于麻省理工学院从事博士后研究,1997至2000年于哈佛大学从事博士后研究。
研究方向是材料化学的交叉学科前沿,包括用于生物医药的功能性生物材料设计与修饰以及其他纳米与生物学领域的基本问题。徐兵教授曾获得汤森路透2014、2015及2016年化学领域高被引科学家,Kenneth Rainin基金会创新奖(2013),人类前沿科学研究奖(2008-2011)。
http://www.x-mol.com/university/faculty/4519
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号