Nature Chem:转运氯离子,小分子抗癌新战术?
细胞自噬(autophagy)顾名思义就是指细胞自我吞噬,尤其是当细胞在营养不良或是受到外界伤害时,细胞的这种行为可以帮助其度过困难时期。发现这一现象背后机理的日本科学家大隅良典也在去年收获了诺贝尔生理学或医学奖。细胞凋亡(apoptosis)是细胞程序性的主动死亡,在复杂的调控下可以去除机体不需要或异常的细胞,对生物体的进化、内环境的稳定以及系统发育意义重大。在细胞过度增殖的肿瘤中,细胞自噬的水平比正常细胞高,而细胞凋亡则被压制。因而能调控这两种生理过程的药物,很有希望用于抗癌治疗。
通常情况下,细胞质的氯离子浓度为5-40 mM,而细胞外的氯离子浓度要高的多,约为120 mM。跨膜的离子转运蛋白和离子通道对于维持这种浓度差异起着重要作用。而细胞内氯离子浓度的改变,会影响细胞内的pH值以及自噬过程,并会引发细胞凋亡。英国南安普顿大学Philip Gale、美国德州大学奥斯汀分校Jonathan Sessler以及韩国延世大学Injae Shin等人之前的研究表明,人工合成的离子转运分子(synthetic ion transporter,下图)能够促进氯离子进入细胞,提高细胞内氯离子和钠离子浓度并诱发细胞凋亡(Nature Chem., 2014, 6, 885-892)。不过,这些离子转运分子对于细胞自噬过程的影响还不清楚。近日,他们在Nature Chemistry上发表了进一步的研究成果,基于方酰胺(squaramide)的人工合成离子转运分子可以促进脂质体模型中的氯离子转运以及细胞中的氯化钠流入,这与后续的caspase依赖性细胞凋亡相关。此外,一种离子转运分子能引起溶酶体pH值的变化,损害溶酶体酶活性并扰乱自噬过程,而且这种作用与离子转运分子引发的凋亡相互独立。他们的工作首次通过实验证实离子转运分子即可诱导细胞凋亡又可扰乱细胞自噬。
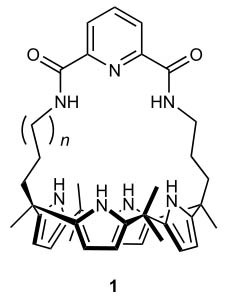
之前工作报道的离子转运分子。图片来源:Nature Chem.
文中首先讨论了6种合成的离子转运分子,它们为单方酰胺3,以及其他一些方酰胺衍生物4-8。这些方酰胺可以结合氯离子,并通过脂质双分子层进行离子传输,实验结果显示离子转运效率的顺序为 3 > 5 > 6 > 4 >> 7 ∼ 8。在此过程中,作者没有观察到钠离子的转运。作者将7和8的低转运效率归因于其可以结合两个氯离子,致使结合物为-2价,而高价态的化合物不易于通过非极性的脂质双分子层。
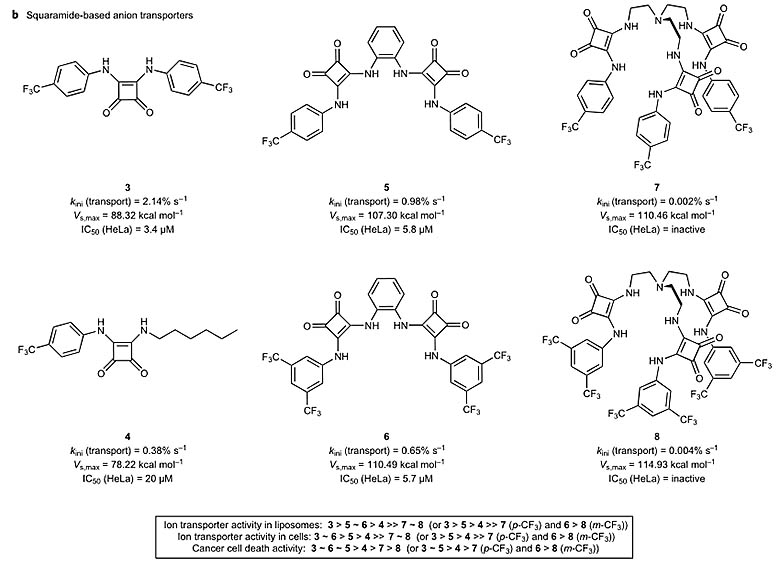
6种合成离子转运分子的结构。图片来源:Nature Chem.
作者研究了离子转运速率与分子表面静电势能的关系(下图b),其结论为7、8结合离子能力太强,4结合离子能力太弱,所以它们的转运效率都不高。有效的离子转运既需要分子能在膜的一边结合离子又要保证在另外一边能够快速释放离子,而分子3就满足了这样的条件。
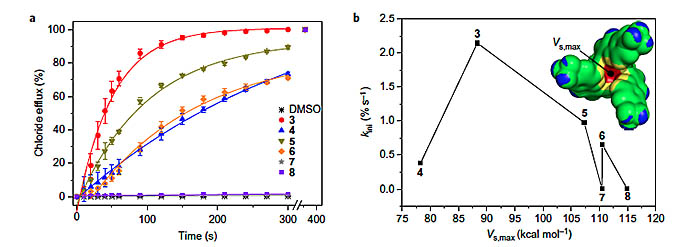
分子3-8对氯离子的转运效率及与分子表面静电势能的关系。图片来源:Nature Chem.
在细胞凋亡实验中,作者在HeLa细胞和A549细胞中分别加入了离子转运分子3、5、6以及一种常见的细胞凋亡引发剂PCCP。通过流式细胞仪检测,发现3、5、6处理后的细胞展现出阳性的annexin V结合及PI摄入,这说明细胞凋亡已经发生。作者也观察到了细胞的缩小,这排除了细胞坏死的可能(因细胞坏死会导致细胞肿胀)。通过JC-1法还检测到了线粒体膜电位的降低,这是细胞凋亡的另一个标志。这些实验证据证明3、5、6能够诱导细胞凋亡。
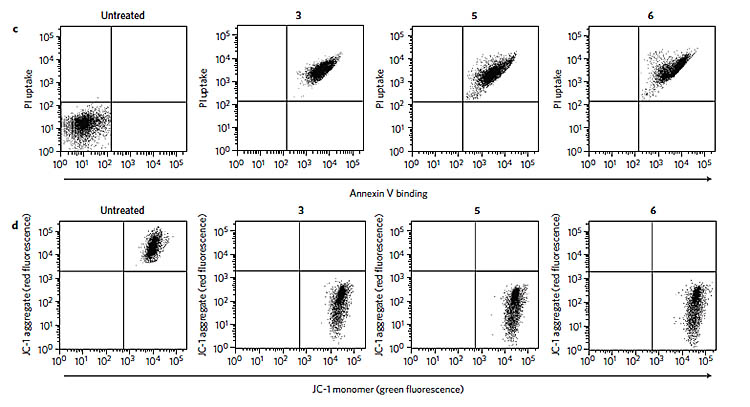
流式细胞仪检测以及JC-1线粒体膜电位检测。图片来源:Nature Chem.
在研究离子转运分子对细胞自噬影响的实验中,作者发现离子转运分子3的加入会使得溶酶体pH值明显升高,从正常的5以下提高到7左右,但离子转运分子5、6、8却没有这种作用。对溶酶体酶活性的研究表明,只有离子转运分子3能抑制溶酶体酶活性。为了直接研究3对细胞自噬的影响,作者研究了细胞自噬的标志蛋白LC3-II及p62。正常发生自噬的细胞中,LC3-II蛋白水平会升高而p62蛋白水平会降低;一旦自噬过程被扰乱,LC3-II及p62的水平都会升高。经过3处理的HeLa细胞中,LC3-II及p62的水平都明显升高。这些实验证据证明了3可以扰乱细胞自噬。另外,作者也证明了3对细胞自噬的扰乱和对细胞凋亡的诱导通过相互独立的通路发生,互不影响,而且前者先于后者发生。
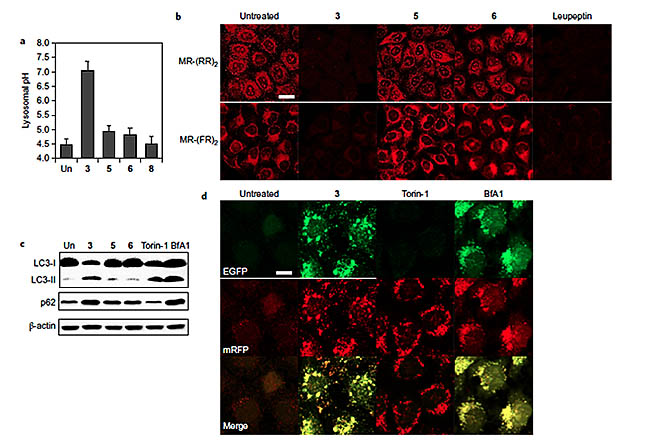
合成离子转运分子对细胞自噬的影响。图片来源:Nature Chem.
细胞自噬和凋亡贯穿于细胞发育生长以及生理病理等过程,研究这两个过程不仅具有理论意义同时也具有应用价值。作者希望通过合成离子转运分子而调控细胞自噬以及凋亡,从而可以在抗癌药物的研究中找到一条新的道路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A synthetic ion transporter that disrupts autophagy and induces apoptosis by perturbing cellular chloride concentrations
Nature Chem., 2017, DOI: 10.1038/nchem.2706
(本文由PhillyEM供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号