Nature Mater.:借助外显子组测序技术,纳米疫苗实现个性化癌症免疫治疗
合成肽疫苗是一种仅含免疫决定簇组分的小肽,是采用人工方法按天然蛋白质的氨基酸顺序合成保护性短肽,与载体连接后加佐剂所制成的疫苗,被视为最为理想的疫苗,也是研制预防和控制感染性疾病和恶性肿瘤的新型疫苗的主要方向之一。目前,合成肽疫苗的抗肿瘤效果在临床上所面临的主要问题有三点:疫苗不能有效地运输至引流淋巴结、免疫耐受性以及细胞毒性T细胞之间的自相残杀。此外,如何针对不同的病人实现个性化的癌症免疫治疗仍是人们所面临的巨大挑战。
近些年来,外显子组测序(exome sequencing)技术的发展为此开辟了一条途径,它是利用序列捕获技术将全基因组外显子区域DNA捕捉并富集后,并进行高通量测序的基因组分析方法。通过高通量测序技术进行外显子组测序,能够直接发现肿瘤中与蛋白质功能变异相关的遗传突变。借用此技术,科学家可以人工合成肿瘤新抗原(neoantigen),这是一类因基因突变而编码出的新的未知蛋白质或多肽,以其良好的肿瘤特异性逐渐被重视和利用。
尽管外显子组测序标志着个性化免疫治疗的新纪元,但目前还缺少一种通用的方法来利用肿瘤新抗原来刺激细胞毒性T细胞的应答。

Anna Schwendeman教授和James Moon教授。图片来源:University of Michigan
日前,来自于美国密歇根大学的Anna Schwendeman教授和James Moon教授通过模仿高密度脂蛋白,合成了一种由磷脂和类载脂蛋白组成的纳米圆盘(sHDL),利用它负载抗原肽和佐剂,可以显著地提高抗原与佐剂运输到淋巴器官的效率,并且能在树突状细胞上显示出持续的抗原呈递作用,产生大量的毒性T细胞,可以特异性的识别肿瘤细胞并将其杀死。此外,这种方法还适用于多表位的抗原肽,以此产生广谱的T细胞响应,可以有效地抑制高侵袭性、低免疫原性肿瘤的生长。通过与免疫检查点阻断相联用,可以进一步提高其功效,最终能完全消除肿瘤。相关成果已发表于Nature Materials杂志上。
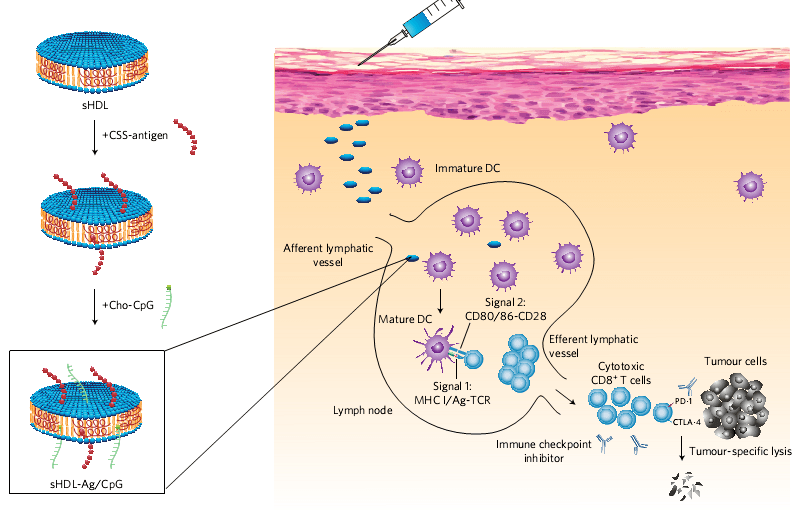
基于纳米圆盘的疫苗的设计及其肿瘤杀伤作用原理。图片来源:Nature Mater.
研究人员所合成的纳米圆盘是由磷脂和类载脂蛋白的肽组成。与从人血浆中提取或是通过体外重组方法得到的载脂蛋白不同,这种类载脂蛋白的肽源于载脂蛋白中重复的α螺旋区域,是由22个氨基酸合成,它与内源性载脂蛋白的序列没有同源性,因而可以避免机体产生自免疫的潜在风险。临床测试证实其最大的安全剂量高达2.2 g/m2,这比大多数的聚合物及无机纳米粒子高出1到2个数量级。
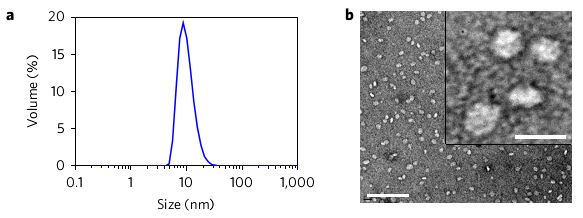
纳米圆盘的尺寸以及形貌。图片来源:Nature Mater.
接着,研究人员将特定的抗原肽(Ag)与佐剂CpG修饰在纳米圆盘上,得到个性化定制的疫苗(sHDL-Ag/CpG)。该疫苗平均直径约为10.5 nm,平均每个圆盘能负载6.5个抗原肽和1个CpG分子。
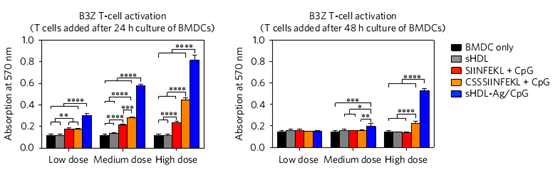
树突状细胞与不同的疫苗共孵育后对T细胞的活化效果。图片来源:Nature Mater.
借助于纳米圆盘的载体功能,抗原肽与佐剂能够被运输到树突状细胞的内涵体/溶酶体中,通过氧化还原响应,细胞内会持续释放抗原肽与佐剂,因而可以促进持久的抗原呈递,使树突状细胞成熟,并通过 MHC-I类分子提呈给CD8+ T细胞,使得T细胞得以活化。
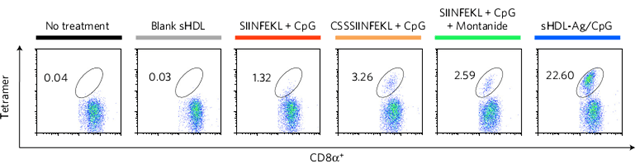
经sHDL-Ag/CpG接种的小鼠体内可产生大量细胞毒性T细胞。图片来源:Nature Mater.
接下来,研究人员进一步探索了sHDL-Ag/CpG在小鼠体内的作用。结果表明,sHDL-Ag/CpG可以使小鼠体内产生大量的细胞毒性T细胞,并且可以有效地抑制B16OVA癌细胞的增殖。此外,sHDL-Ag/CpG并未显示出毒性,而且不会引起小鼠的自身免疫反应。
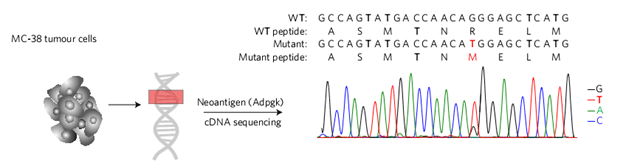
纳米圆盘负载肿瘤新抗原用于个性化免疫癌症治疗。图片来源:Nature Mater.
为了证实纳米圆盘对个性化免疫癌症治疗的可用性,研究人员通过对MC-38癌细胞中突变蛋白进行测序,并依此合成特异性的肿瘤新抗原Adpgk,将其负载于纳米圆盘上制得疫苗sHDL-Adpgk/CpG。通过对小鼠进行接种,研究人员发现sHDL-Adpgk/CpG产生的新抗原特异性的细胞毒性T细胞是普通可溶性疫苗的47倍,且比目前为止临床试验最强的油性佐剂高出31倍。此外,当与anti-PD-1相联用时,sHDL-Adpgk/CpG能够实现彻底根除MC-38肿瘤的功能。
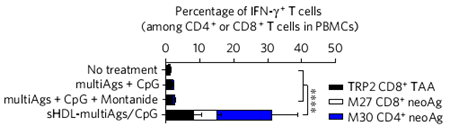
多表位疫苗用于消除高侵袭性,低免疫原性肿瘤。图片来源:Nature Mater.
最后,研究人员将纳米圆盘应用到B16F10肿瘤的治疗上。由于B16F10癌细胞拥有高侵袭性、低免疫原性,因而普通的疫苗难以治疗。研究人员通过将多种抗原肽负载于纳米圆盘上,配制出多表位疫苗,从而可以产生广谱的T细胞响应。通过与anti-PD-1以及anti-CTLA-4联用,可以完全消除B16F10肿瘤。
总而言之,这项研究为抗原肽的高效运载提供一种新的方法,也为个性化肿瘤免疫疗法提供了一种通用的策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Designer vaccine nanodiscs for personalized cancer immunotherapy
Nature Mater., 2016, DOI:10.1038/NMAT4822
(本文由冰供稿)
