JACS:蛋白质的N-H键活化?
多肽的化学修饰对于药物研发、生物材料以及生物分子探针的设计意义重大。但是,大部分针对多肽或者蛋白质的结构修饰都局限于支链的改造。我们知道,自然界经过亿万年的进化,能够神奇精准的对蛋白质或者肽链的某一特定位置进行修饰(如乙酰化、甲基化等),这种看似简单的操作对于生存却意义重大,这种微小的结构变化对于稳定蛋白质的三维结构以及通过选择性识别蛋白-蛋白相互作用来抑制某些酶的活性。比如细菌通过N-甲基化调控自身产生抗生素,生物体内组蛋白的乙酰化水平与肿瘤的产生息息相关。
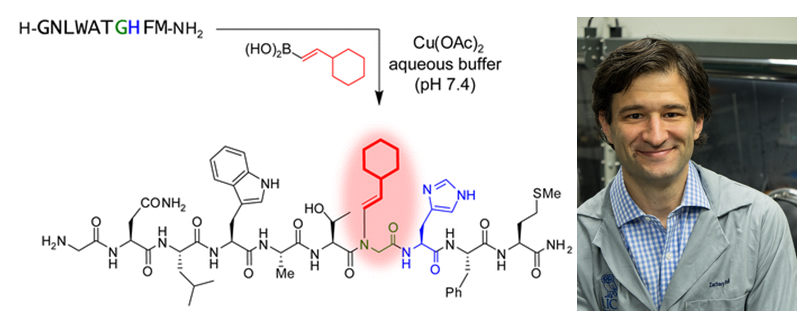
目前多肽中氨基的烷基化或者芳基化仍存在很大挑战。尽管可以用非自然的氨酰-tRNA合成酶来实现非自然肽链的合成,但使用N-取代的非天然氨基酸的报道非常有限。固相合成是另一种很好的取代方法,但是一旦涉及到N-烷基取代的氨基酸,往往兼容性就出现问题。而关于肽链骨架氨基的直接修饰方法就更少了。基于此,美国莱斯大学的Zachary Ball(有机牛人Barry M. Trost的学生)课题组开发了二价铜催化的肽链骨架N-H键活化(组氨酸定位基团)。(Histidine-Directed Arylation/Alkenylation of Backbone N–H Bonds Mediated by Copper(II). J. Am. Chem. Soc., 2016, 138, 7472-7475, DOI: 10.1021/jacs.6b03390)
图片来源: JACS/Rice University
首先,作者用短链蛋白质促甲状腺激素释放激素(TRH,下图中1)作为模型,在NMM缓冲液中,芳基硼酸化合物2在醋酸铜催化下与1发生N-芳基化得到化合物3。质谱、核磁二维谱及二级质谱确定修饰位点在组氨酸邻位焦谷氨酸N上(此反应与Chan−Lam偶联反应类似,但后者需要碱性条件且一般在无水环境中甚至加热才能实现)。进一步的对照试验证明组氨酸残基的存在必不可少,且修饰专一发生在组氨酸前一氨基酸的氨基上。

图片来源: JACS
得到此结果后,作者扩大了肽链以及硼酸化合物的多样性。如下图所示,Leuprolide(4)是一个与TRH类似N末端为Glp的多肽,对芳基硼酸及烯基硼酸的适应性都非常好。而另一多肽angiotensin I(5)相对比较惰性,但烯基硼酸对此多肽相对于芳基硼酸活性要好很多。另外由于angiotensin I另一H6组氨酸的存在,会有混合产物出现,这也是此方法的一个缺陷(多个组氨酸存在影响定位)。

图片来源: JACS
大招自然在最后,尝试了不同长度的多肽后,作者用了蛋白质溶菌酶(lysozyme,∼14 kDa)作为底物,并选用三种不同的芳基三氟硼酸盐(化合物15、16、17)进行14位精氨酸(15位为组氨酸)的定点修饰。化合物15和16修饰的产物可以通过Click Chemistry与coumarin进行荧光显色(小小僧不明白为什么不直接用带有coumarin的硼酸盐做),化合物17可以与脱硫生物素pull-down并通过affinity purification,得到的修饰后蛋白质的分子量符合预期(因为只有一个组氨酸所以是单一位点修饰)。
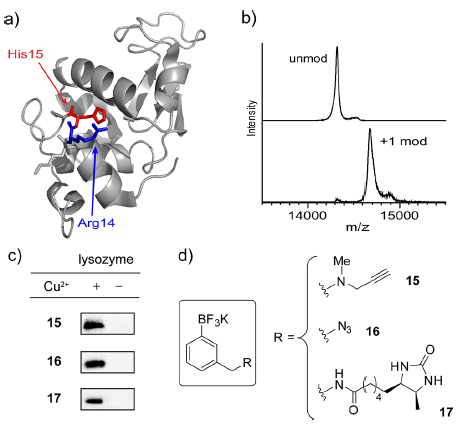
图片来源: JACS
小小僧点评:
1)此方法可以实现短链多肽甚至蛋白质特定位点N-H键活化(组氨酸作为定位基团),这是其特点也是其缺陷;2)此方法可以在中性pH的水相环境中进行,生物体系兼容性强;3)对于此方法的后期改良小小僧很期待。Click Chemistry一家独大太久了。
http://pubs.acs.org/doi/ipdf/10.1021/jacs.6b03390
(本文由扫地小小僧供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号