药物版“战神金刚”——首例HDAC6-Proteasome双靶点抑制剂组合成功
如果你了解《机甲舰队》,那么你的年纪就暴露了!80年代这句台词一起,跟现在“摩擦,摩擦,魔鬼的步伐”之类的神曲一样,总是让笔者不自觉的跟着和。

“组成脚和腿,组成躯干和手臂,我来组成头部,前进战神金刚!”
为了对抗以静息状态的白血病干细胞(LSCs)为特征的急性髓性白血病(AML),科学家采用BCL-2抑制剂Venetoclax和DNA甲基转移酶抑制剂azacitidine的组合,结果相当成功,总响应率达78%。
但是,不像人们吃了主食再来点甜品,患者未必会喜欢同时吃两种药,尤其还是副作用较大的抗癌药。著名的“神奇子弹”(magic bullets)定义里也不包括组方,“一病一药(one-disease-one-drug)”一直是制药界追求的目标。这就产生了矛盾:这种靶向单一靶点的药物分子往往对多因素引起的疾病并不那么奏效,如代谢疾病、肿瘤和神经相关疾病。
为了调和这种矛盾,科学家想出来许多方法,比如双靶点药物(dual drug)、蛋白降解靶向嵌合体(proteolysis-targeting chimeria, PROTAC)和抗体偶联药物(antibody-drug conjugate, ADC)等。抗体偶联药物最早于2000年上市,即Pfizer研发的Mylotarg,但因为致死性毒性在2010年撤市,给ADC浇了一盆凉水,另外一直存在的血液不稳定性等问题导致ADC进展缓慢。而PROTAC还处于概念阶段,尽管学界和科研界报之以乐观态度,但挺进临床应用尚需时日。
今天笔者想讨论的是组蛋白去乙酰化酶(HDAC)相关的双靶点药物,它有以下三点优势:(一)多靶点性质可能带来更好的药效;(二)由于是一个小分子,药代动力学更好预测;(三)口服一种药物患者更容易接受。目前,已经有从实验室走向临床实验的双靶点药物,如下图所示的HDAC抑制剂(HDACi)和多激酶抑制剂(CUDC-101)、PI3K抑制剂(CUDC-907)、氮芥(tinostamustine)及LSD1抑制剂(4SC-202)形成的双靶点药物。由于HDAC抑制剂会存在血液毒性(主要是抑制HDAC1-3),选择性的抑制成为开发的重点,其中HDAC 6抑制剂是热点。
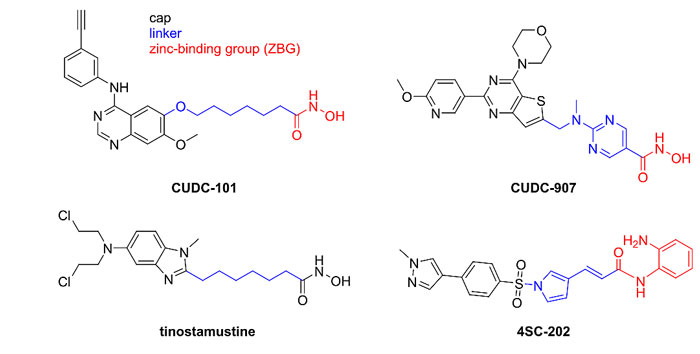
几种基于HDACi的多靶点药物。图片来源:J. Med. Chem.
双靶点药物最重要的原理是“一药多靶(one drug multiple targets)”。如果这两个(也许多个)靶点在机制上是协同的,那么可以预测在体内将会发挥协同效应。本文介绍的HDAC6-proteasome就是属于这类。HDAC6是其家族成员中唯一的细胞质蛋白,对于介导细胞中两种主要的清除错误折叠蛋白机制——蛋白酶体(proteasome)途径和聚集体(aggresome)途径都有着协助作用。一方面,HDAC6在其伴侣分子p97/VCP协助下将泛素化的错误折叠蛋白递送到蛋白酶体中降解;另一方面,如果错误折叠蛋白大量积累超过蛋白酶体的处理能力,HDAC6会通过其参与形成的微管运输到聚集体,再通过溶酶体降解。
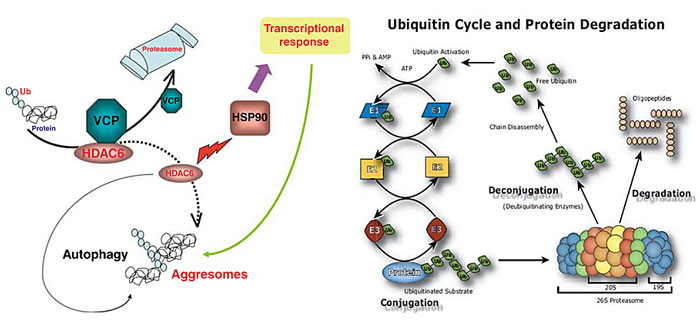
HDAC6生理作用示意图。图片来源:Oncogene [1]
因此,可见同时抑制HDAC6和蛋白酶体将会大大增加错误折叠蛋白的积累,导致细胞凋亡。德国杜塞尔多夫大学Julia Hauer和莱比锡大学Finn K. Hansen等科学家在这个原理上,将HDAC抑制剂鳌合锌离子的羟肟酸“弹头”嫁接到蛋白酶体抑制剂ML-16母核上得到RTS-V5双靶点药物。晶体结构也证实RTS-V5能有效的插入到蛋白酶体β –β'环中,同时也能进入HDAC6的催化中心与锌离子结合。
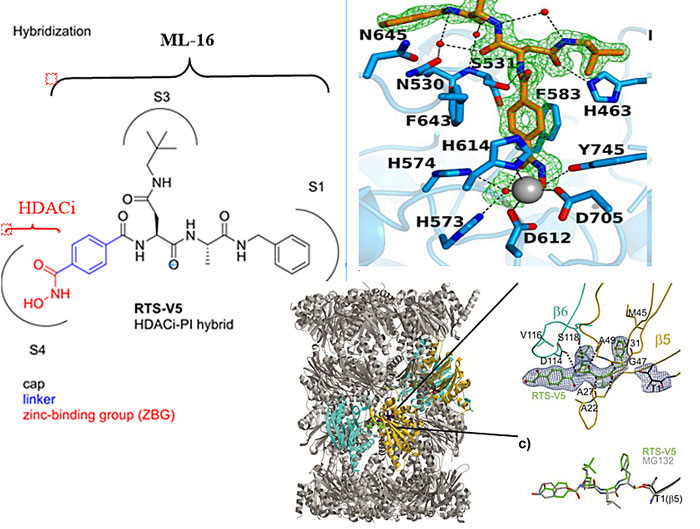
RTS-V5结构及与双靶点的结合。图片来源:J. Med. Chem.
生化、细胞学实验证实,RTS-V5选择性抑制HDAC6,上调微管蛋白乙酰化,并能发挥同硼替佐米类似的抑制蛋白酶体的效果。
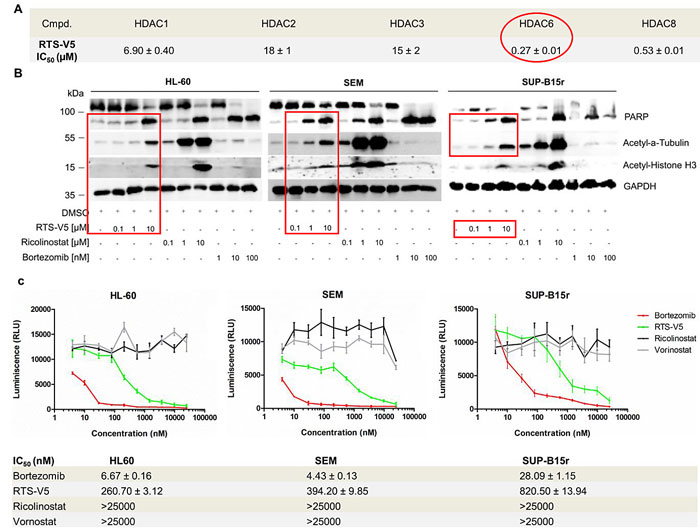
RTS-V5抑制HDAC6和蛋白酶体活性的生化和细胞学研究。图片来源:J. Med. Chem.
对几种白血病细胞和多发性骨髓瘤细胞及来自病人的BCP-ALL细胞系进行抗增殖研究发现,RTS-V5表现出与HDAC6选择性抑制剂ricolinostat相当或更好的抑制活性,对于TKI耐药的细胞系SUP-B15r和KCL-22r也有较强抑制。同时,观察到聚集体积累减少,这与其机制相关。另外,研究人员对来自健康个体的外周血单核细胞(PBMCs)进行测试,发现对其毒性很小(IC50 > 25 μM),相比ricolinostat更安全(IC50 < 10 μM)。实验表明,RTS-V5有较好的安全窗。
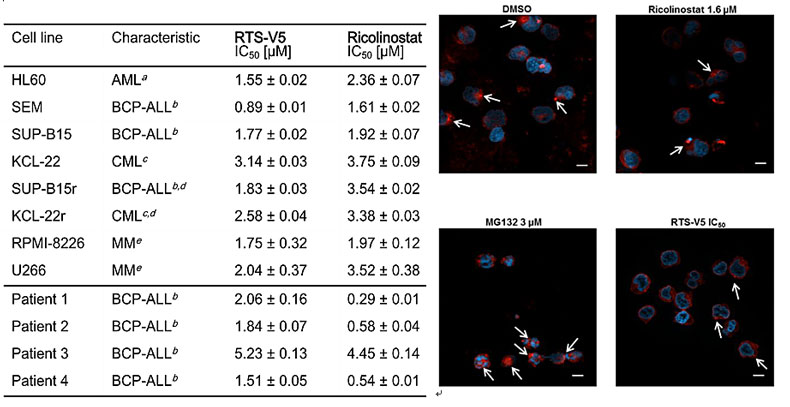
RTS-V5与ricolinostat细胞毒性的对比以及对聚集体的影响。图片来源:J. Med. Chem.
这篇文章至此戛然而止,虽然逻辑上很清晰,但让笔者颇有意犹未尽之感。一向以严谨著称的德国科学家,没想到也干“标题党”的勾当,PK/PD数据缺乏,仅仅做了一个细胞水平的活性实验,就自诩是“first-in-class”。要知道平均7万个化合物里,只有1个能从实验室走向市场!不知道他们是藏着好数据准备再发一篇好文章,还是为进行临床试验保密,还是进一步实验数据糟糕先把手里的工作发篇JMC“止损”,看不透啊。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of the First-in-Class Dual Histone Deacetylase-Proteasome Inhibitor
J. Med. Chem., 2018, 61, 10299-10309, DOI: 10.1021/acs.jmedchem.8b01487
参考文献:
1. HDAC6, at the crossroads between cytoskeleton and cell signaling by acetylation and ubiquitination. Oncogene, 2007, 26, 5468–5476.
(本文由西北望供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号