董广彬课题组Nat. Chem.:钯/降冰片烯催化芳香烃的互补位点选择性官能化
芳香烃的位点选择性官能化过程在医药和材料的研究中应用广泛。通常情况下,芳香烃的官能化是通过亲电芳香取代(EAS)反应来实现的,随后发生进一步本位(ipso)转化。因此,这种取代倾向于发生在更富电子和位阻更小的位点(图1a)。如何实现EAS反应不利位点(如吸电子取代基(EWG)的对位或给电子取代基(EDG)的间位)的选择性官能化成为人们关注的问题。目前人们发展了导向基团(DG)策略和位阻敏感的C−H键硼化/硅烷化的方法解决这一问题,并取得了突破性的进展,但寻找互补位点选择性的解决方案仍然备受关注。
钯/降冰片烯(Pd/NBE)协同催化(即Catellani型反应)为解决上述问题提供了可行的方法,芳基-NBE钯杂环中间体可同时实现与亲核试剂及亲电试剂偶联,由此得到邻位、本位双官能化或邻位双官能化的产物。芳香烃亲电卤化后进而发生邻位官能化理论上可以实现互补位点选择性官能化过程但该类催化反应受到“邻位约束”的限制,当使用邻位非取代的卤代芳香烃时,反应通常不会得到单邻位官能化的产物,而是得到包含NBE结构的复杂混合物或双官能化产物(图1b)。因此,只要能够克服这一内在限制,将大大提高Pd/NBE催化的效率,从而实现非活化位点的芳香烃官能化。
芝加哥大学化学系的董广彬教授(点击查看介绍)课题组便成功利用Pd/NBE协同催化体系解决了这一问题。他们设计了一种桥头修饰的NBE,可用于与邻位未取代的芳基碘化物反应,完成其单邻位官能化。该方法通过两步依序反应实现了多种底物的非常规位点选择性官能化(如EWG的对位、EDG的间位),还完成了对复杂天然产物和活性药物分子的C−H键位点选择性胺化(图1c)。相关工作发表在Nature Chemistry 上。
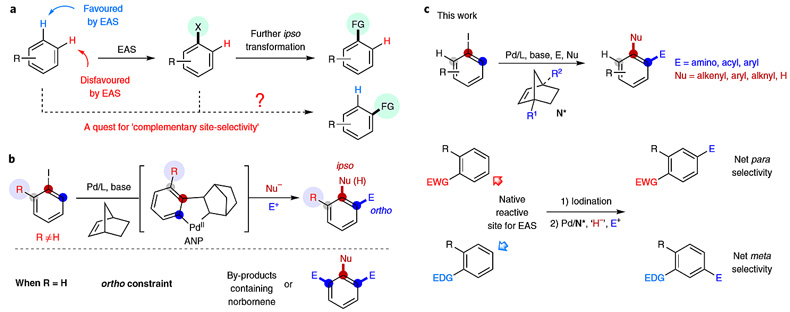
图1. 芳香烃的互补位点选择性官能化。图片来源:Nat. Chem.
Catellani等人研究表明,使用邻位未取代的芳基碘化物作为底物的挑战在于其更容易发生第二次C-H键金属化,而不是β-碳消除。如图2所示,在过渡态(TS)中,新修饰的亲电基团(E)必须指向桥头位置,相反,在β-碳消除的过渡态(TS)中,芳基环平面必须采用与桥头C−H键几乎垂直的取向。因此,抑制第二次C−H键金属化并促进β-碳消除的关键在于如何控制TS中芳香基团的取向。如果在NBE桥头(即C1或C4)位置修饰合适的取代基,取代和亲电基团之间的空间相互作用或取代基与Pd配体之间的空间相互作用将抑制C−H键金属化,同时通过固定芳香环的取向来促进β-碳消除(图2b)。
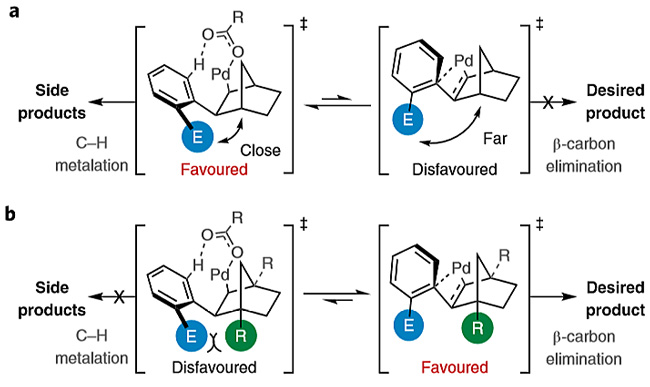
图2. 反应存在的挑战及可能的解决方案。图片来源:Nat. Chem.
为了验证这一假设,作者选择邻位胺化/Heck反应作为模型反应,以3-碘甲苯(1a)为底物,苯甲酰氧胺3a为亲电试剂,丙烯酸叔丁酯2a为亲核试剂,对邻位胺化反应进行了研究,考察不同结构修饰的NBEs(图3,entry 1),取代基的大小和位置非常重要,增加NBE的空间位阻可以促进β-碳消除,但也会降低其底物结合能力,并产生Heck副产物(4a')。桥头位置(N2-N5)修饰烷基取代基的NBE均能有效地促进所需的单胺化产物生成(4a),其中正庚基取代的N3参与反应的效果最佳,酯或苯基取代的N6或N7仅能促进微量的4a产生。他们还对一系列配体进行考察,RuPhos作为配体时,目标产物1a的产率最高。作者以N3为辅助试剂,对反应进行了进一步优化,钯、膦配体和NBE对这一转化都是必不可少的(entry 2-4)。使用碳酸钾作为碱比碳酸铯的产率(entry 7)大大降低,1,4-二氧六环/甲苯混合溶剂体系优于单用使用其中任意一种溶剂(entry 8和9),降低温度会降低反应的转化率(entry 10)。
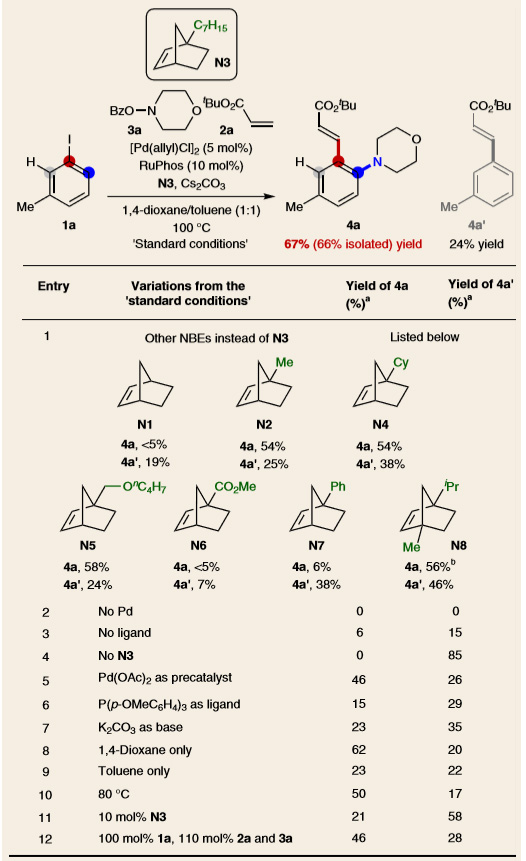
图3. 反应条件的筛选。图片来源:Nat. Chem.
有了最佳的反应条件,作者对碘代芳香烃的适用范围进行了考察(图4)。富电子(4a-4g)和缺电子的(4h-4j)芳基碘化物都适用于该反应体系,空间位阻大的取代基通常会通过抑制第二次C-H键金属化来提高目标产物的产率(从4a到4c),当底物中含有位阻小的间位取代基(如甲氧基)时,具有较大位阻环己基修饰的NBE(N4)对反应更有效(4d)。叔胺(4f)、硅醚(4g)、酯(4h)、硝基(4j)和氯原子(4n)等官能团都能够很好地兼容,咔唑、喹啉和噻吩等杂芳香基,萘基(4o-4r)修饰的底物也可顺利发生反应。各种苯甲酰氧胺,如保护基修饰的哌啶酮、哌啶和Boc保护基修饰的哌嗪(4s-4x)等可以成功地用于该体系,甚至包括衍生自帕罗西汀(4u)的复杂底物也取得了中等的收率。丙烯酸甲酯和丙烯酸正丁酯也都可以在本位顺利地发生偶联。更复杂的底物如药物分子雌酮和氯雷他定同样以良好的产率得到了相应的胺化产物(4ab和4ac)。
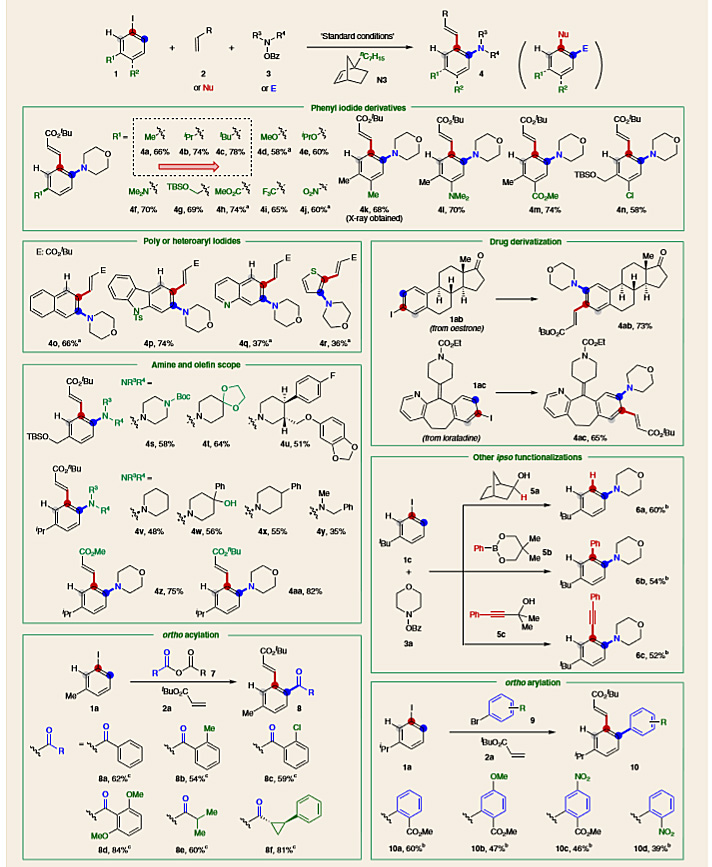
图4. 底物适用范围的考察。图片来源:Nat. Chem.
为了彰显这一反应的实用性,作者还研究了不同淬灭条件下本位转化的反应,除Heck偶联外,在本位分别实现了还原(6a)、Suzuki偶联(6b)及Sonogashira偶联(6c)反应。此外,N3辅助试剂对单邻位酰基化和邻位芳基化也有效,表明该方法具有广泛的适用性。
接下来,作者考察了对位取代的芳基碘化物参与的反应,该类底物更容易发生第二次C-H键金属化。作者合成了在两个桥头位置都具有烷基取代基的N8,以抑制第二次C–H键金属化。简单的苯基碘化物(11a)能以55%的收率得到所需的单官能化产物(12a),单/双选择性大于20:1(图5a)。尽管反应效率仍有待提高,但这是首例使用Pd/NBE催化体系实现邻位和间位未取代芳基碘化物单官能化的反应。在其它位置(N9或N10)具有取代基的NBE或常规NBE(N1)参与反应则没有得到相应的产物。具有EDG或EWG对位取代基的碘代芳香烃都能顺利地得到所需的单取代产物(12b和12c),表现了该反应体系的普适性(图5b)。
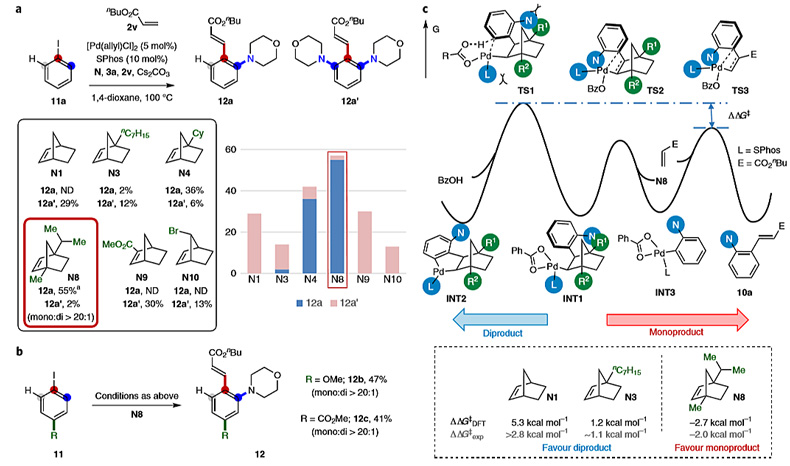
图5. 对位取代芳基碘化物的反应情况。图片来源:Nat. Chem.
为了了解N8辅助试剂的关键作用,作者采用密度泛函理论(DFT)进行了计算研究(图5c)。他们以碘代苯为模型底物,分别以N1、N3或N8为辅助试剂,比较第二次C-H键金属化、β-碳消除和迁移插入(Heck淬灭)步骤的关键过渡态。从中间体INT1出发,二取代产物通过第二次C-H键金属化(TS1)形成,单取代产物通过β-碳消除(TS2)和随后的迁移插入(TS3)形成。其中,丙烯酸酯2v的迁移插入是单取代产物12a形成的决速步,其选择性(12a:12a')由TS1与TS3之间的ΔΔG‡决定。另一方面,N3的桥头取代基修饰使ΔΔG‡降至1.2 kcal•mol-1。当位阻进一步增加,两个桥头位置都被取代(N8)时,C-H键金属化的能垒明显增大,相反,β-碳消除和迁移插入步骤表现出较低的活化能。
最后,作者利用连续的亲电碘代和邻位官能化在EAS不利的位置引入氨基官能团,产率中等至良好(15a-f)。该反应还进一步用于复杂分子的后期位点选择性衍生化。例如,士的宁(马钱子碱)C5位的位点选择性胺化只需要两步,简洁高效,而传统的方法需要七步。此外,药物长春西汀也可以在C5位选择性地官能化,而在EAS条件下,C4位更容易反应(21a对21b)。考虑到在药物中间体中引入氨基的重要性,这种方法对药物的研发极具价值。
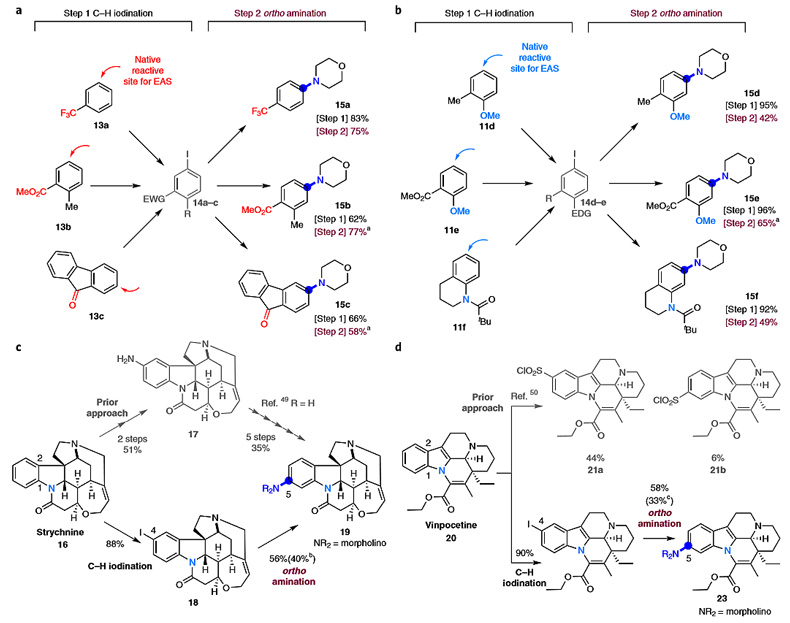
图6. EAS反应互补位点选择性的官能化。图片来源:Nat. Chem.
总结
董广彬教授课题组发展了一类新的NBE辅助试剂,克服了Pd/NBE催化体系中长期难以解决的“邻位约束”问题,EAS反应不利的位点选择性活化,实现了芳香烃互补位点选择性的官能化。该方法还可用于复杂分子的后期修饰,具有良好的底物适用性和官能团兼容性,为发展具有更广泛应用范围的活性/选择性催化体系打开了大门。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Complementary site-selectivity in arene functionalization enabled by overcoming the ortho constraint in palladium/norbornene catalysis
Nat. Chem., 2018, 10, 866, DOI: 10.1038/s41557-018-0074-z
导师介绍
董广彬
http://www.x-mol.com/university/faculty/352
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号