众里寻她:基于结构的新型选择性PAK4抑制剂的设计与发现
基于靶标的药物设计是现代药物发现中的重要手段。但受限于靶标家族结构间的同源性和相似性,如何在众多结构相似的靶标间精准设计高选择性化合物靶向调控目的靶标,时至今日仍是一项极具挑战性的研究工作。伴随着药物化学和结构生物学的深度融合,基于结构的药物设计(Structure-based drug design,SBDD)为发现高选择性的抑制剂带来了新的契机。
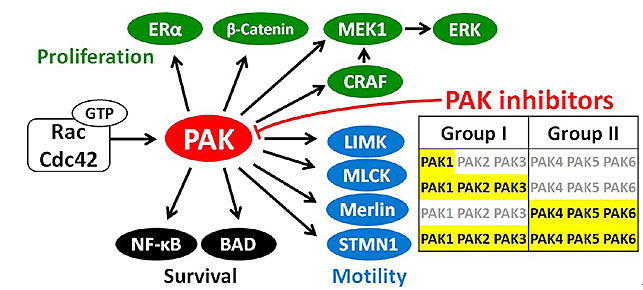
p21活化激酶(p21-activated kinases,PAKs)共有六个家族成员,根据其序列同源性及活化方式的不同,可分为两大类:I类PAKs(PAK1、2、3)和II类PAKs(PAK4、5、6)。作为Rho家族GTP酶Rac和Cdc42的重要下游效应分子,PAKs在细胞增殖、细胞骨架重组、细胞运动过程中发挥着重要的作用。研究表明,PAKs各成员,特别是其代表成员PAK1和PAK4,在多种肿瘤细胞及组织中存在基因扩增、基因突变、表达水平和活性上调的现象,与肿瘤的发生发展密切相关。通过抑制肿瘤细胞内PAKs的异常活性,有望抑制肿瘤细胞的过度增殖、侵袭转移和血管生成,促进肿瘤细胞的凋亡。有鉴于此,PAKs抑制剂的研究在近十年受到药物化学家的关注。然而,新近研究发现抑制I类PAKs与心脏急性毒性、hERG副作用等安全性风险具有潜在的相关性,提示PAKs抑制剂的开发应避免对I类PAKs特别是PAK2的抑制作用。因此,发现高选择性的II类PAKs抑制剂将成为未来研究的主流。
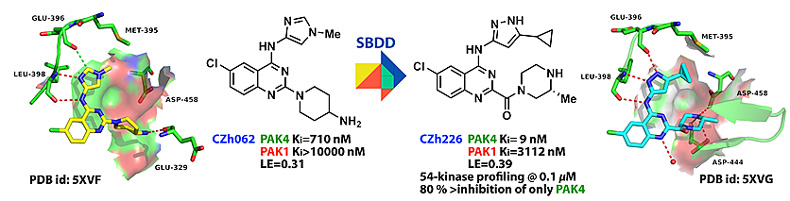
图1. 基于结构的喹唑啉类选择性PAK4抑制剂CZh226的优化发现。
近日,沈阳药科大学程卯生教授课题组、清华大学李海涛教授课题组、中国医科大学李丰教授课题组组成的研究团队通力合作,利用基于结构的药物设计方法,针对PAK4蛋白结构特征,设计发现了一系列新结构选择性PAK4小分子抑制剂,并对其生物活性和结合模式进行了研究(J. Med. Chem., 2018, 61, 265–285)。如图2所示,研究人员在统计分析现有PAKs结晶结构信息的过程中,发现两类PAKs的DFG片段Asp458PAK4和Asp407PAK1羧基侧链存在显著的构象取向差异。这一有趣的结构差异现象引起了研究者的好奇。虽然DFG片段在激酶家族成员中保守存在,但研究人员认为通过精细调节抑制剂分子与靶标DFG片段Asp残基的几何和电性匹配,有望使抑制剂在PAKs家族内甚至激酶整体家族内实现选择性。
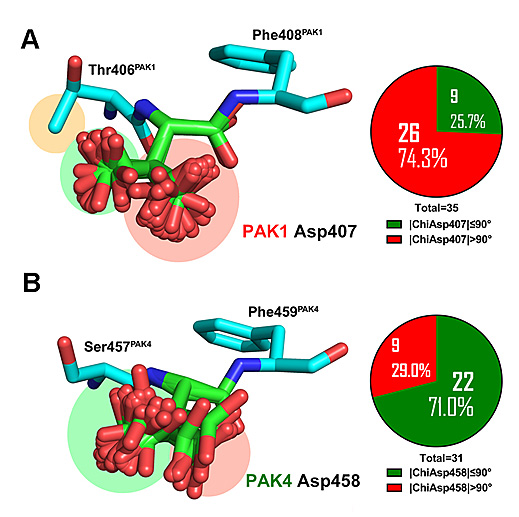
图2. PAK1蛋白DFG片段Asp407PAK1(A)和PAK4中Asp458PAK4(B)羧基侧链构向差异。
基于上述假设,研究人员在先导化合物10a(CZh062)的基础上利用羰基的sp2杂化的性质调整侧链夹角约60°,设计了新结构2-胺酰基-4-胺基喹唑啉类化合物。经多轮结构改造与优化,筛选发现高活性、高选择性PAK4抑制剂化合物31(CZh226),其PAK4 Ki = 9 nM,PAK1 Ki = 3112 nM,PAK1/PAK4选择性达到346倍。
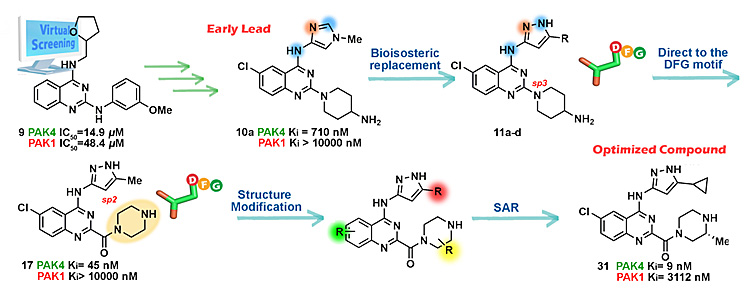
图3. 喹唑啉类选择性PAK4抑制剂的优化发现过程。
进一步的激酶组选择性评价结果显示(图4),化合物CZh226具有良好的PAKs家族成员内选择性和激酶组选择性,是目前已知选择性最优的Type I型PAK4抑制剂,适合用于PAK4信号通路和靶点验证的进一步研究。
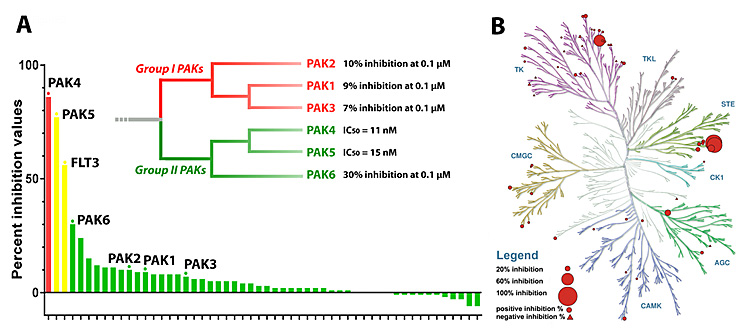
图4. CZh226激酶选择性评价。
为揭示化合物的选择性产生的分子机制,研究者通过结构生物学研究获得优选化合物CZh226与PAK4的共结晶复合物(图5A),确认了其结合模式,证明Asp458PAK4和Asp407PAK1羧基侧链构象差异、Phe397PAK4和Tyr346PAK1、P-loop疏水空腔“upper pocket”和核糖区“floor pocket”等结构差异因素可以作为实现PAK4选择性抑制的结构基础。
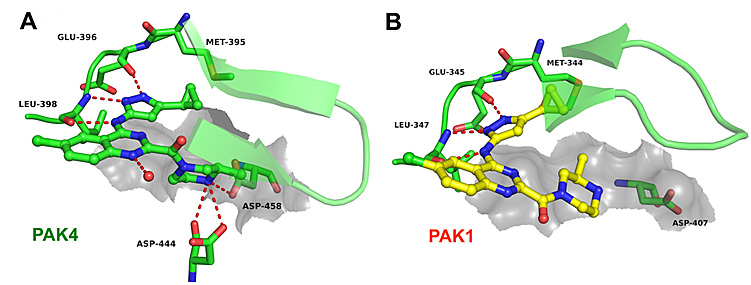
图5.(A)CZh226与PAK4蛋白共结晶(5XVG)(B)CZh226与PAK1蛋白分子对接模型。
进一步的细胞活性评价结果显示,化合物CZh226可以强效抑制PAK4高表达的A549细胞的迁移侵袭,而对于PAK4低表达的NCI-H460细胞及人体正常细胞的运动影响较弱。机制研究发现该化合物主要通过下调PAK4-LIMK1-cofilin信号通路以及鸟嘌呤核苷酸交换因子(GEF-H1)和基质金属蛋白酶抑制A549细胞的迁移侵袭。类药性评价发现化合物CZh226具有良好的类药参数和物理化学性质、良好的大鼠微粒体代谢稳定性和人血浆稳定性。初步安全性评价发现,化合物CZh226对人CYPs和hERG通道无明显抑制作用。对化合物CZh226的大鼠体内药代动力学性质评价发现,静脉给药具有较好的半衰期及药物暴露量。针对该选择性抑制剂深入抗肿瘤药效学评价和生物机制研究目前正在进行中,本研究将为开展以PAK4为靶点的抑制剂设计与靶点验证研究奠定基础。
这一成果作为ACS Editors'Choice论文近期发表于Journal of Medicinal Chemistry。本文的第一作者为沈阳药科大学郝晨洲博士、清华大学博士研究生赵帆和新加坡材料研究与工程研究所(A*STAR)宋红岩博士。沈阳药科大学程卯生教授、赵冬梅教授,中国医科大学李丰教授和清华大学李海涛教授为该文共同通讯作者。该研究得到国家自然科学基金委、创新药物研究与设计省部共建教育部重点实验室等的支持。
该论文作者为:Chenzhou Hao, Fan Zhao, Hongyan Song, Jing Guo, Xiaodong Li, Xiaolin Jiang, Ran Huan, Shuai Song, Qiaoling Zhang, Ruifeng Wang, Kai Wang, Yu Pang, Tongchao Liu, Tianqi Lu, Wanxu Huang, Jian Wang, Bin Lin, Zhonggui He, Haitao Li, Feng Li, Dongmei Zhao, Maosheng Cheng
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure-Based Design of 6-Chloro-4-aminoquinazoline-2-carboxamide Derivatives as Potent and Selective p21-Activated Kinase 4 (PAK4) Inhibitors
J. Med. Chem., 2018, 61 (1), pp 265–285.DOI: 10.1021/acs.jmedchem.7b01342
导师介绍
程卯生
http://www.x-mol.com/university/faculty/49792
赵冬梅
http://www.x-mol.com/university/faculty/49793
李丰
http://www.x-mol.com/university/faculty/49794
李海涛
http://www.x-mol.com/university/faculty/44741
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号