发现G蛋白偶联受体蛋白新的别构位点
G蛋白偶联受体蛋白(GPCRs)又称七次跨膜螺旋膜蛋白。GPCRs参与着人体的各种生理功能,包括神经信号传递,细胞分化,视觉,嗅觉等1-3。人类的重大疾病如老年痴呆症、癌症、艾滋病也与GPCRs密切相关。GPCRs是最为热门的药物设计和筛选靶标蛋白,目前40%左右的上市药物都是基于GPCRs而设计4,5。因此研究和理解GPCRs的结构与功能,对当今药物设计至关重要。
一个蛋白质的特有生理功能与活性,是由它特定的三维结构决定的。因此从蛋白三维结构来理解GPCRs的功能是当今药物设计中必不可少的一个环节。随着结构生物学技术突飞猛进的发展,截止到2018年7月,已经了50多个不同种类的GPCRs结构被解析出来。这其中涵盖了GPCRs 的A、B、C和F亚家族。在这些解析的结构当中,人们发现药物小分子可以结合在GPCRs的不同部位,这其中包括传统的正构位点(orthosteric site)和多个别构位点(allosteric site),诸如:膜外ECL2 loop区域,第一、二跨膜螺旋区域,第二、三跨膜螺旋区域,第三、四跨膜螺旋区域,第四、五跨膜螺旋区域、膜内G蛋白结合区域。不同的小分子结合位点所处的化学环境有所不同,这样则给当代药物发现与设计提供了新的机遇。
尽管传统结构生物学对人们理解蛋白的生理功能提供了不可或缺的方法和信息,但它也有自己的缺陷。比如传统结构生物学不能告诉人们为什么GPCRs结合激动剂(agonist)之后可以被激活,而结合拮抗剂(antagonist)的时候为什么信号通路会被阻断。此外,单个GPCRs晶体结构也不能告诉人们GPCRs具体的激活动态过程是怎样的。与之相比,计算结构生物学则很好的弥补了传统结构生物学的不足6,7。比如:通过在计算机上构建磷脂双层和溶剂模型,可以模拟GPCRs在细胞生理环境下的动态过程(图一)。
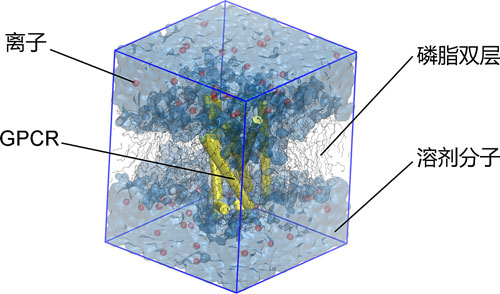
图一. 分子动力学模拟GPCR膜蛋白体系。
最近,洛桑瑞士联邦理工学院和上海科技大学的研究者们通过计算生物学中分子动力学与系统分析的方法,找到GPCRs A家族的一个新的别构位点。首先作者把天然激动剂乙酰胆碱(ACh)分子放在乙酰胆碱受体(muscarinic acetylcholine receptors)膜外部分,然后实施长时间尺度的全原子分子动力学模拟。通过计算机模拟,作者发现在最开始的时候,乙酰胆碱分子很长一段时间(将近0.5-1.0微秒)停留在人们传统所认为的正构位点区域(图二 a-c)。当时在此之后,随着第六跨膜螺旋(TM6)上一个保守的色氨酸(W6.48)的构象变化,乙酰胆碱分子可以进入乙酰胆碱受体的更深区域(图二 b)。在模拟结束的时候,乙酰胆碱分子最后停留在第二跨膜螺旋(TM2)一个保守的天冬氨酸(D2.50)附近(图二 e,g)。
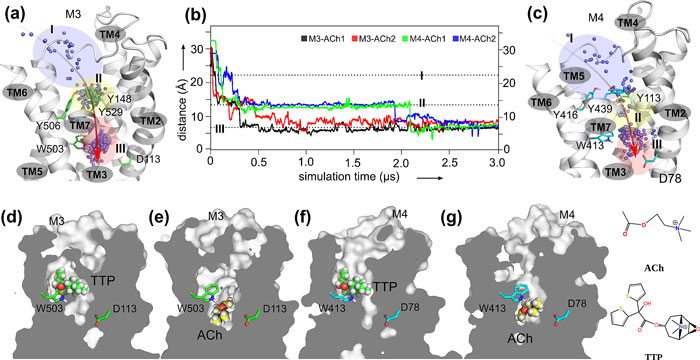
图二. 分子动力学模拟寻找到乙酰胆碱天然激动剂乙酰胆碱ACh的新的结合位点。(a) 乙酰胆碱分子质心在M3乙酰胆碱受体模拟过程位置的变化。(b) 乙酰胆碱分子质心到天冬氨酸 (D2.50)的距离随着模拟时间的变化。(c)乙酰胆碱分子质心在M4乙酰胆碱受体模拟过程位置的变化。(d)拮抗剂TTP在M3乙酰胆碱受体模拟中最后的位置。(e)激动剂乙酰胆碱ACh在M3乙酰胆碱受体模拟中最后的位置。(f)拮抗剂TTP在M4乙酰胆碱受体模拟中最后的位置。(e)激动剂乙酰胆碱ACh在M4乙酰胆碱受体模拟中最后的位置。
通过分析小分子与受体的相互作用指纹图谱,作者引入了生化突变实验。突变结果进一步佐证了这一新的结合模式(图三)。
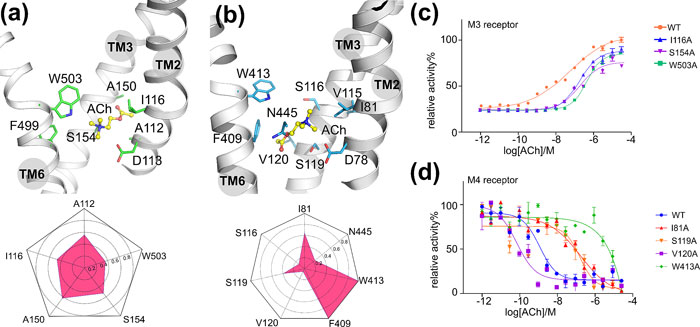
图三. 激动剂乙酰胆碱ACh与乙酰胆碱受体相互作用指纹图谱与生化突变实验结果。
通过系统分析所有GPCRs结构,作者发现这个新发现的结合位点存几乎存在于所有的GPCRs结构当中(图四)。
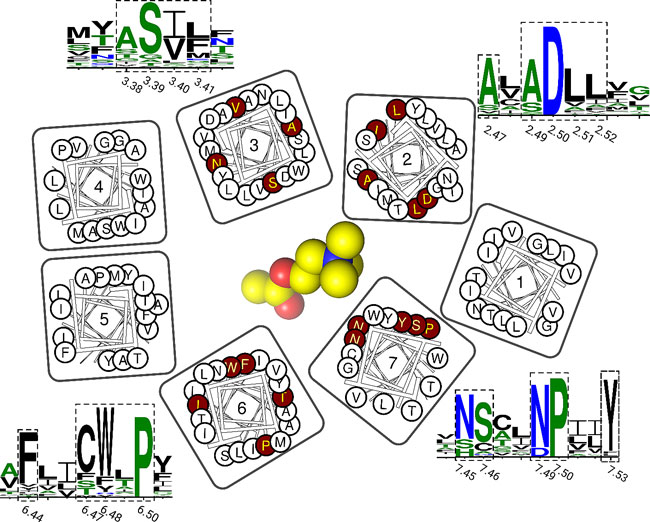
图四. 新发现的别构位点的保守性。
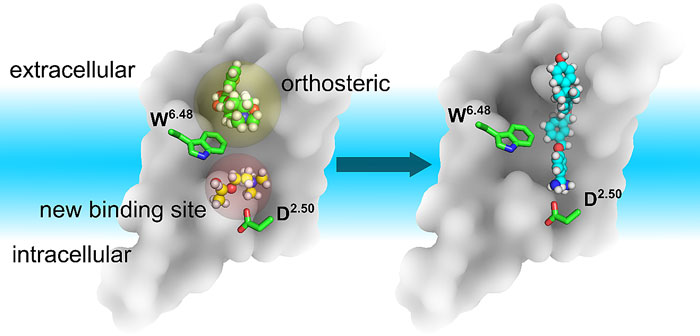
图五. 新发现的别构位点在药物设计中的应用。
在本文工作中,作者通过计算生物学的方法发现了GPCR的一个新的别构位点(allosteric site)并且得到生化突变实验的佐证。基于此,人们可以通过结合传统的正构位点 (orthosteric site)与这个新的别构位点结合的方式来得到新的化学环境(图五),从而为设计高度专一活性的药物分子提供新的机遇。
本工作的预览版本在2018年7月14日在线发表于Chemical Science 8。本文第一作者为Stephen Chan,由袁曙光博士指导。上海科技大学王静静博士为共同一作。主要通讯作者为洛桑瑞士联邦理工学院(EPFL)袁曙光博士。共同通讯作者为上海科技大学刘志杰教授与洛桑瑞士联邦理工学院(EPFL)Horst Vogel教授。
参考文献
1. Skolnick, J., Gao, M., Roy, A., Srinivasan, B. & Zhou, H. Implications of the small number of distinct ligand binding pockets in proteins for drug discovery, evolution and biochemical function. Bioorganic & medicinal chemistry letters, 25, 1163-1170, doi:10.1016/j.bmcl.2015.01.059 (2015).
2. Marti-Solano, M., Schmidt, D., Kolb, P. & Selent, J. Drugging specific conformational states of GPCRs: challenges and opportunities for computational chemistry. Drug discovery today, 21, 625-631, doi:10.1016/j.drudis.2016.01.009 (2016).
3. Guo, Z. et al. Identification of protein-ligand binding sites by the level-set variational implicit-solvent approach. J Chem Theory Comput,11, 753-765, doi:10.1021/ct500867u (2015).
4. Huang, J., Lakkaraju, S. K., Coop, A. & MacKerell, A. D., Jr. Conformational Heterogeneity of Intracellular Loop 3 of the mu-opioid G-protein Coupled Receptor. J Phys Chem B, 120, 11897-11904, doi:10.1021/acs.jpcb.6b09351 (2016).
5. Lakkaraju, S. K., Lemkul, J. A., Huang, J. & MacKerell, A. D., Jr. DIRECT-ID: An automated method to identify and quantify conformational variations--application to beta2 -adrenergic GPCR. J Comput Chem, 37, 416-425, doi:10.1002/jcc.24231 (2016).
6. De Vivo, M., Masetti, M., Bottegoni, G. & Cavalli, A. Role of Molecular Dynamics and Related Methods in Drug Discovery. Journal of medicinal chemistry, 59, 4035-4061, doi:10.1021/acs.jmedchem.5b01684 (2016).
7. Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B. & Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov, 16, 829-842, doi:10.1038/nrd.2017.178 (2017).
8. Chan, H. C. S. et al. Exploring a new ligand binding site of G protein-coupled receptors. Chemical Science, doi:10.1039/C8SC01680A (2018).
作者简介
袁曙光,2009年获得中科院上海有机化学研究所硕士学位。2009年10月获得欧盟玛丽居里全额奖学金资助,先后在比利时鲁汶大学(KULeuven),波兰科学院,洛桑瑞士联邦理工学院(EPFL)完成博士学位。2013年6月获得最佳博士论文奖。近年来,袁曙光博士一直致力于GPCRs计算机模拟研究。通过全原子长时间尺度的分子动力学模拟(all-atom long time scale molecular dynamics simulation),揭示GPCRs的激活机制和小分子的特异性原理。2013年,作者首次发现了钠离子在鸦片受体(mu opioid receptor)的激活过程中的机理 (Angew Chem Int Edt,2013, doi:10.1002/anie.201302244)。2014年,作者通过对Rhodopsin, A2AR和β2AR三个GPCRs受体的系统研究, 首次发现了GPCRs被激活的时候,在GPCRs内部能够形成连续的水分子通路 (Nature Communication, 2014, doi:10.1038/ncomms5733)。同年作者又揭示了GPCRs 形成水分子通路的开关(Angew Chem Int Edt, 2013, doi:10.1002/anie.201409679)。该理论此后被一系列生化实验所证实。目前该理论已经成为GPCR激活机制研究不可或缺的组成部分。2015年,作者发现了鸦片受体的小分子特异性原理,系统阐述了为什么两个结构上非常相似的小分子其中一个是激动剂,而另外一个则是拮抗剂(Angew Chem Int Edt, 2015, doi:10.1002/anie.201501742)。该工作并被主编选定为热门文章。2016年,作者揭示了5-HT1A受体的立体选择性原理(Angew. Chem Int Edt, 2016, doi:10.1002/anie.201603766)。同年,作者还发现了P2Y1受体两种不同的拮抗剂抑制机制(Angew Chem Int Edt, 2016, doi:10.1002/anie.201605147)。此外,袁博士基于GPCR所设计的2个药物分子,已经成功进入临床一期测试阶段。除了在GPCR领域的突出贡献,袁博士在酶催化领域也有所建树。近两年他以共同通讯作者身份先后发表了JACS (2018,doi:10.1021/jacs.7b10278),Nature communications (2017,doi:10.1038/s41467-017-01508-1),JACS (2017,10.1021/jacs.7b06019)。
http://www.x-mol.com/university/faculty/45898
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!











































 京公网安备 11010802027423号
京公网安备 11010802027423号