余金权课题组Nat. Chem.:不对称亚甲基C-H键活化构建手性C-F键
亚甲基(-CH2-)是有机化合物中最常见的基团之一,当亚甲基上连接的两个取代基不相同时,选择性地将-CH2-中的其中一个H原子转化为其他基团可以构建新的碳立体中心。通过不对称C-H键官能化(一般指非活性C-H键)的途径将亚甲基转化为手性碳主要有三种策略,第一类是通过攫取CH2中的H获得•CH自由基,随后•CH自由基在酶或手性金属催化剂的诱导下完成不对称自由基反应(图1A),如手性Fe卟啉催化苄基C-H键的羟基化以及手性Cu催化苄基C-H键的氰基化(点击阅读相关);第二类是金属催化剂与底物先形成金属杂氮宾、卡宾,随后立体选择性地对亚甲基C-H键协同插入(图1B),如Rh卡宾与烷烃C-H键的不对称烷基化(点击阅读相关)、Fe氮宾与苄位C-H键的不对称胺化(点击阅读相关);第三种是金属先立体选择性地插入亚甲基C-H键形成金属-手性碳络合物,即不对称C-H键活化(图1C),随后进一步官能化,如Pd、Ir、Rh催化亚甲基C-H键不对称芳基化、烯基化、烷基化。[1] 目前,如何通过不对称C-H键转化,尤其是基于分子间反应将非活化的CH2转化为其他官能团取代的手性碳中心成为化学家研究的热点。
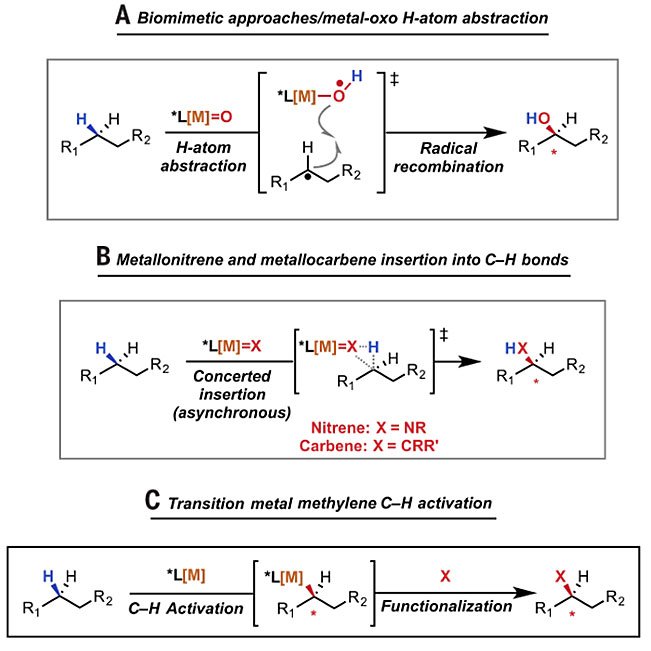
图1. 通过亚甲基C-H键活化构建手性碳中心。图片来源:Science [1]
近日,美国斯克里普斯研究所(The Scripps Research Institute, TSRI)的余金权教授(点击查看介绍)团队利用亚甲基不对称C-H键活化的策略,成功实现了Pd(II)催化苄位C-H键的氟化反应。该方法使用氨基酰胺作为手性瞬态导向基团并作为配体,控制Pd(II)催化剂立体选择性地插入苄位C-H键,并促进Pd(IV)中间体还原消除形成手性C-F键。相关成果发表在Nature Chemistry 上。
与其他构建手性C-F键的方法相比,亚甲基的立体选择性C-H键活化能更直接、更线性地实现手性C-F键的合成,并且符合原子经济性、绿色环保的理念,极具吸引力。2014年,普林斯顿大学的John Groves教授曾报道通过苄位H攫取/自由基反应来构建C-F键。遗憾的是,文章中只有一例对映选择性的苄位C-H键氟化(25% ee)。[2] 2015年,余金权教授和浙江大学的史炳锋教授分别报道了Pd(II)催化的不对称C-H键活化构建苄位的手性C-F键,两种方法都利用底物中的手性辅基诱导C-F键的非对映选择性合成。[3-4] 然而,如何利用不对称苄位C-H键的转化来实现对映选择性地构建C-F键成为人们思考的问题。
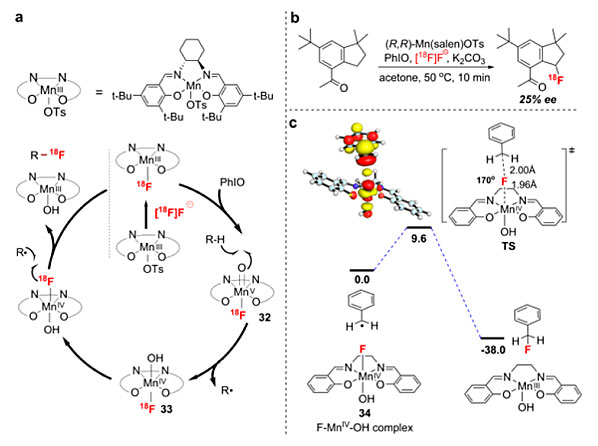
图2. 苄位H攫取/自由基反应来构建C-F键。图片来源:J. Am. Chem. Soc.[2]
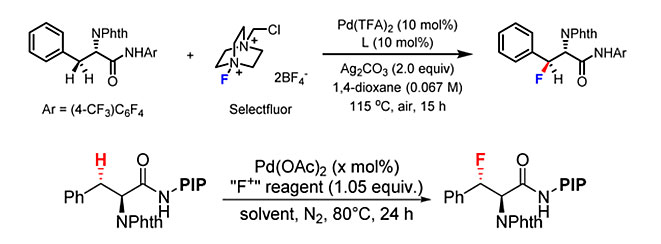
图3. C-H键活化实现非对映选择性的苄位C-H键氟化。图片来源:J. Am. Chem. Soc. [3-4]
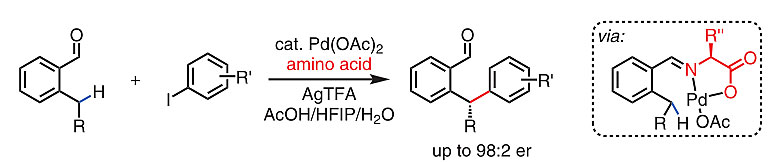
图4. C-H键活化实现苄位C-H键的对映选择性芳基化。图片来源:Science [5]
2016年,余金权教授使用手性氨基酸同时作为瞬态导向基和配体,通过Pd(II)催化C-H键活化的途径成功实现了苄位C-H键的对映选择性芳基化反应(点击阅读相关),[5] 这一策略是否也能用来实现苄位对映选择性的C-H键氟化反应引起作者的兴趣。目前,钯催化C(sp3)-H键的氟化主要通过Pd(II)/Pd(IV)的催化循环机理进行,存在两个难点(图5a):第一,Pd(IV)-F中间体形成C(sp3)-F键的还原消除过程相对缓慢,导致亲电氟试剂[F+]只能作为旁观氧化剂(bystanding oxidant),在提高金属氧化态的同时促进形成其他化学键,如C(sp3)-C(sp3)、C(sp3)-杂原子键;第二,C(sp3)-[Pd(IV)(Ln)]-F物种还容易与各种氧、氮亲核试剂发生SN2型反应,形成C(sp3)-O和C(sp3)-N键。以苄位C-H键氟化为例,由于需要促进氨基酸与芳香醛形成亚胺作为导向基团,反应中需要使用羧酸,导致C-F键还原消除面临羧酸参与的SN2反应的竞争问题(图5b)。因此,选择合适的瞬态导向基(配体)和羧酸,既要控制Pd(II)活化C-H键的立体选择性,又要促进形成C-F键并抑制C-O键的形成,是整个反应的关键。
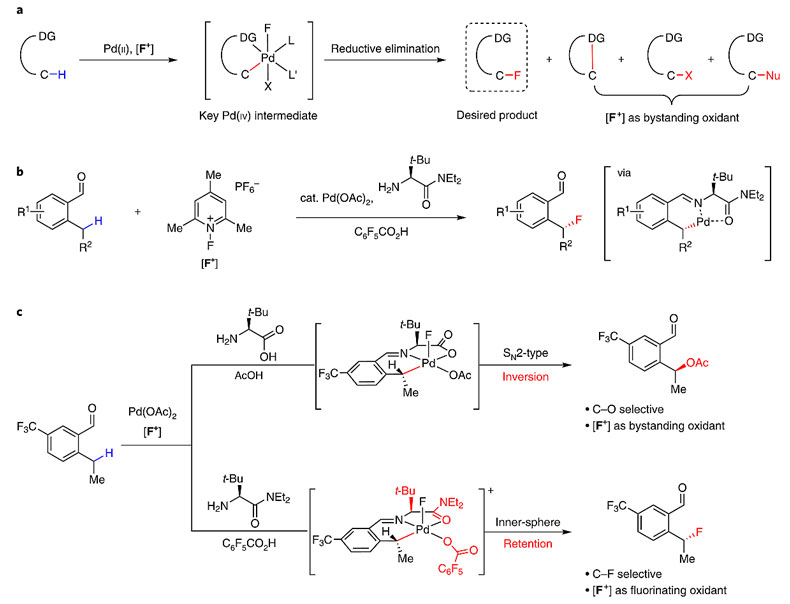
图5. 苄位C-H键对映选择性氟化的难点。图片来源:Nat. Chem.
首先,作者以三氟甲基取代的芳香醛1a作为底物,Pd(OAc)2作为催化剂,氨基酸TDG1作为瞬态导向基,在溶剂AcOH中对亲电氟化试剂进行了初步筛选,其中N-氟-2,4,6-三甲基吡啶盐可以在不氧化芳香醛1a的情况下将Pd(II)氧化为Pd(IV),并生成主要的乙酰氧基化产物2a和少量的苄位氟化产物3a(3a/2a = 1/9.7)。进一步的筛选发现,以氨基酰胺TDG4作为瞬态导向基,苯作为溶剂,使用5当量的C6F5CO2H作为添加剂,反应能以最好的化学选择性(3a/2a=8.7/1)、最高的产率及对映选择性得到氟化产物3a(61%, 91% ee)。
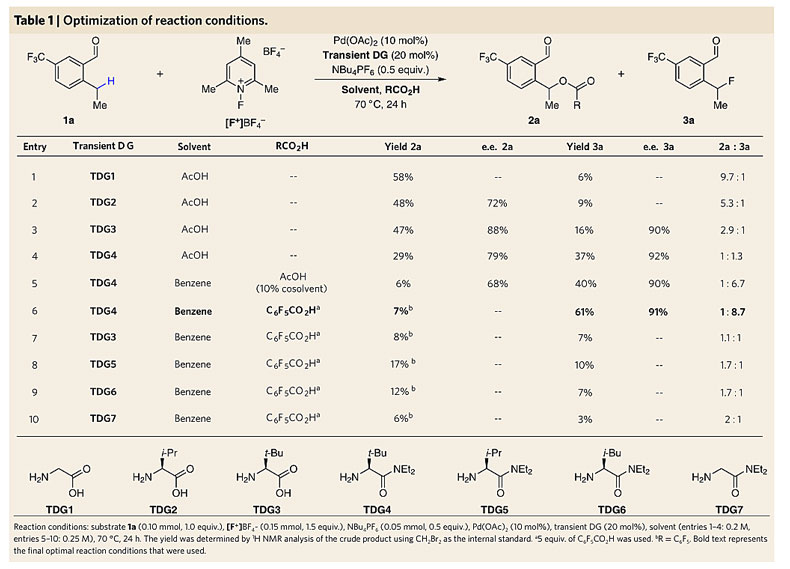
图6. 反应条件的筛选。图片来源:Nat. Chem.
通过X射线单晶衍射分析,作者发现2a和3a中苄位的立体构型截然相反,其中3a的立体构型与此前C-H键芳基化反应的结果一致。氘代实验表明,Pd(II)物种对C-H键的插入为不可逆过程。化学计量实验表明,Pd(II)物种插入C-H键后可得到钯杂环中间体8,8在[F+]和AcOH的作用下可形成苄位构型相反的2a和3a,其中氟化产物3a与8具有相同的苄位立体构型。以上结果表明,Pd(II)物种立体选择性插入C-H键并被[F+]氧化为Pd(IV)物种,随后经过还原消除形成构型保持的氟化产物3a,或经历SN2反应途径得到构型翻转的C-O键产物2a。
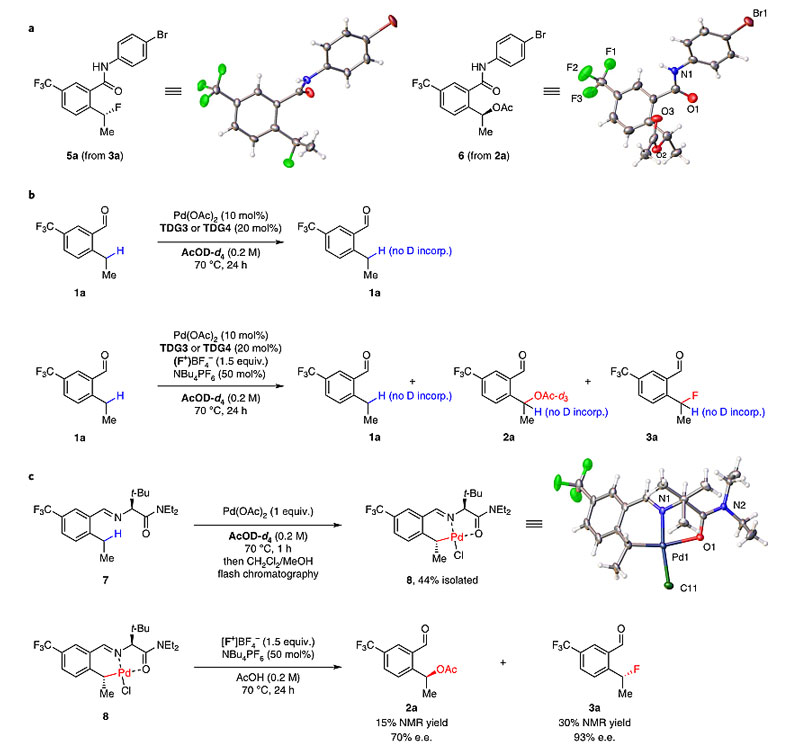
图7. C-F键和C-O键形成的不同途径。图片来源:Nat. Chem.
当使用氨基酸作为瞬态导向基时,C-H键活化形成中性的五配位Pd(IV)中间体(I-III,图8);而以氨基酰胺作为瞬态导向基时,反应则形成阳离子型的五配位Pd(IV)络合物(IV、V,图8)。理论计算表明,后者更倾向于发生还原消除形成C-F键。此外,与AcOH相比,亲核性更弱的C6F5CO2H不仅不利于SN2反应发生,并且较强的吸电子能力也增加了金属中心的正电性,从而在一定程度上促进C-F键的还原消除。
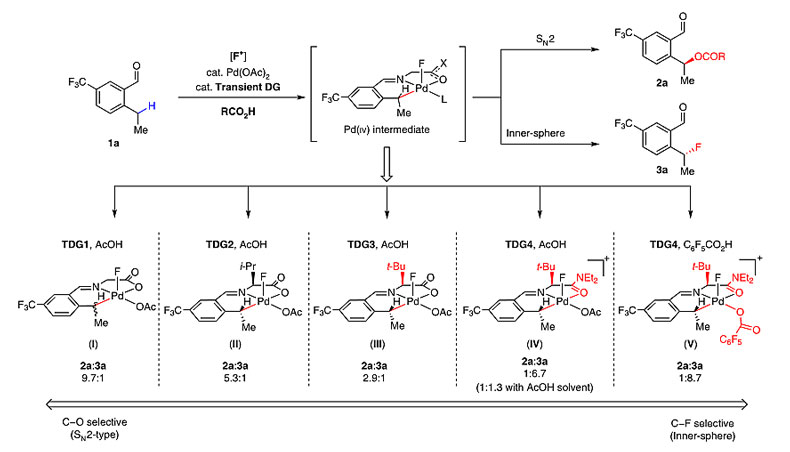
图8. 决定反应化学选择性的因素。图片来源:Nat. Chem.
最后,作者在最佳的反应条件下对底物的适用范围进行考察(图9),苄位上的取代基可以是直链烷烃,而芳香环上的取代基主要是吸电子取代基,如卤素、三氟甲基、硝基、酯基等。当芳香环上无取代基时,反应生成了C(sp2)-H键乙酰氧基化和C(sp3)-H键氟化同时发生的产物3p;而使用芳香环上甲氧基取代的底物参与反应时,则会形成C(sp2)-H键和C(sp3)-H键同时乙酰氧基化的产物2q。此外,芳香环上邻位氟取代的苄位氟化产物3k可以在不同条件下将C(sp2)-F键转化为多种取代基(图8)。
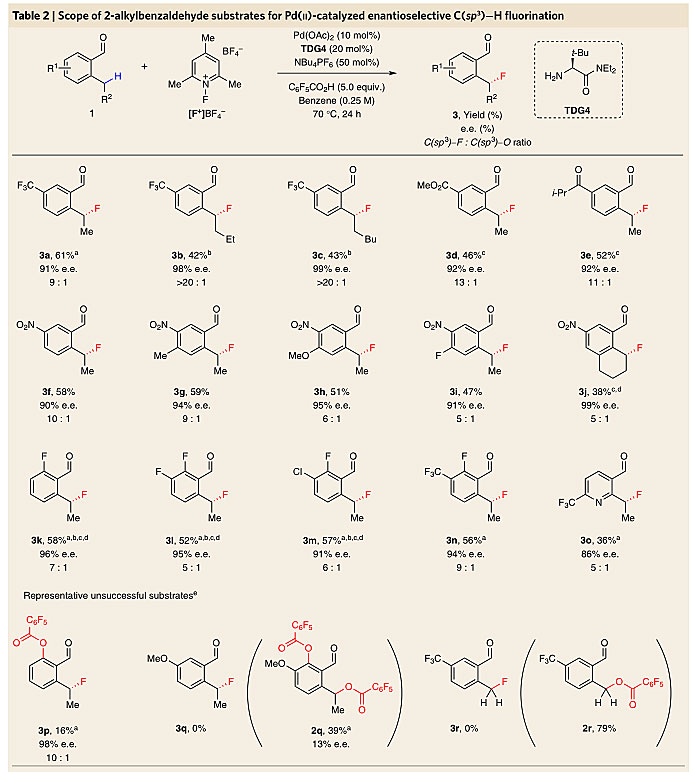
图9. 底物适用范围的考察。图片来源:Nat. Chem.
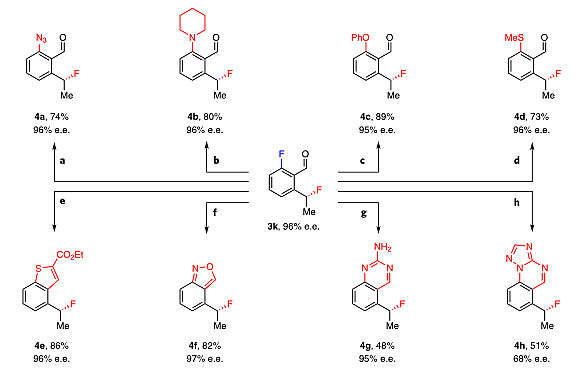
图10. 产物3k的衍生化。图片来源:Nat. Chem.
总结
余金权教授课题组实现了手性瞬态导向基/Pd(II)催化的不对称苄位C-H键氟化反应。他们发现,中性瞬态导向基通过形成阳离子型的Pd(IV)中间体可促进C-F键的还原消除,抑制副反应的发生。接下来,他们将使用这一策略探索其他烷基C-H键的不对称氟化反应。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Controlling Pd(IV) reductive elimination pathways enables Pd(II)-catalysed enantioselective C(sp3)−H fluorination
Nat. Chem., 2018, 10, 755, DOI: 10.1038/s41557-018-0048-1
导师介绍
余金权
http://www.x-mol.com/university/faculty/694
参考资料:
1. Enantioselective C(sp3)‒H bond activation by chiral transition metal catalysts. Science, 2018, DOI: 10.1126/science.aao4798
2. Late stage benzylic C–H fluorination with [18F]fluoride for PET imaging. J. Am. Chem. Soc., 2014, 136, 6842–684, DOI: 10.1021/ja5039819
3. Ligand-Enabled Stereoselective β-C(sp3)–H Fluorination: Synthesis of Unnatural Enantiopure anti-β-Fluoro-α-amino Acids. J. Am. Chem. Soc., 2015, 137, 7067–7070, DOI: 10.1021/jacs.5b04088
4. Stereoselective Synthesis of Chiral β-Fluoro α-Amino Acids via Pd(II)-Catalyzed Fluorination of Unactivated Methylene C(sp3)–H Bonds: Scope and Mechanistic Studies. J. Am. Chem. Soc., 2015, 137, 8219–8226, DOI: 10.1021/jacs.5b03989
5. Functionalization of C(sp3)–H bonds using a transient directing group. Science, 2016, 351, 252-256, DOI: 10.1126/science.aad7893
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号