“我不是药神”:没有剧透,只有你知道或不知道的事实
近日,国产电影《我不是药神》的上映,让“原研药”(又称“品牌药”)和“仿制药”成为了街谈巷议的焦点。电影取材于真实发生在2015年的“陆勇案”,讲述了徐峥饰演的男主角程勇,为了帮助买不起昂贵进口抗癌药的白血病人,从印度大规模走私低价仿制药卖给病人,最终因触犯法律被抓的一系列故事。电影本身笔者不做评论,更关注此片引起的一些讨论话题,包括为什么原研药这么贵、仿制药是不是假药、为什么仿制药价格比原研药便宜、为什么中国人要买印度仿制药等等。今天,笔者和大家一起探讨一二,欢迎在评论区留言讨论。

图片来自网络
为什么原研药这么贵?
制药企业对此的解释,往往是因为需要弥补原研药高昂的研究和开发成本。据制药企业的说法,平均每发现一个新药需要花费的资金和时间分别是10-12亿美元和10-15年(还包括研发失败项目的投入)。另一种说法是,制药企业在专利保护期的市场垄断下,通过高昂的药价只是回收前期投入的研发成本,并创造一定盈利,以便用于支持下一个创新药物的开发。事实真是如此吗?新药研发真的这么花钱吗?药企里辛苦干活的研发人员背得起这么大一口锅么?
新药研发真的很花钱。2016年发表在医学顶级期刊《美国医学会杂志》(JAMA)的一项报告显示,以诺华为例,2014年的研发投入接近了100亿美元。不过,制药企业一样很挣钱。还是以诺华为例,2014年的总销售额高达约580亿美元。这么看来,诺华2014年的研发投入只占销售额的17%。其他制药业巨头也差不多,2014年研发投入占收入之比仅为7-21%,事实上,大多数制药企业的研发投入常年控制在收入的25%以内。[1] 看来,研发成本高并不是药价高的主要原因,最多算是原因之一。
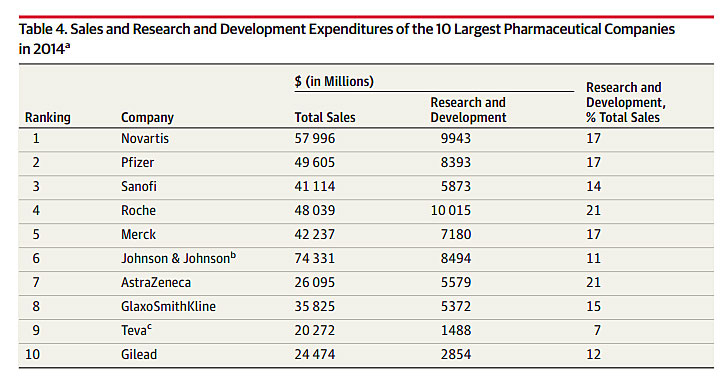
2014年全球十大制药巨头研发占收入比。图片来源:JAMA [1]
对此,默沙东(在美国和加拿大称“默克”,此外的其他国家和地区称“默沙东”)前董事长、总裁兼首席执行官Raymond V. Gilmartin曾表示,“药物的价格并不由其研发成本决定。相反,它是由它们在预防和治疗疾病中的价值所决定的。不论默克公司在开发药物过程中花了5亿美元还是10亿美元,是医生、病人以及买药的人决定了药物的真正价值。”[2] 对于原研药价格高的问题,前美国劳工部长、美国前总统奥巴马经济转型顾问委员会成员、加州大学伯克利分校教授Robert B. Reich在近日接受采访时,更为直接地说道,“一些证据表明大型制药商在市场营销、广告和政治游说上的花费要比他们在研发上的投入要多。制药商的目的是尽可能多地赚取利润,虽然他们不希望病人等死,但他们也不认为向所有患者提供药物是他们的责任。”[3] 显然,制药企业要求的不仅仅是弥补其研发费用,更要填补其他的巨额投入,当然他们还要求超额的利润。实际上,制药企业通过高定价所赚取的利润,要比他们以低定价获取更大市场所赚取的利润多得多。

Robert B. Reich教授。图片来源:UC Berkeley
无论是在美国或是中国,药品的价格高低都牵扯从制药企业到经销商到医院或药店各个环节的实际利益。美国的医院虽然不卖药,但是病人需要拿着医生的处方才能去药店买药,因此一样会看到医药代表通过各种渠道影响医生的决定。例如在流通环节上,据媒体报道,天价进口原研药品到达中国医院之前还要经过多层经销商的“盘剥”,每层平均加价5-7%,此外医院还要加价10-15%,“定价高—回扣高—销售多—利润多”一直都是中国医药市场的潜规则。
有时,为了更高的销售额和利润,一些企业甚至会铤而走险。2013年爆出的“葛兰素史克(GSK)中国行贿事件”,新华社的报道称其“将贿赂成本预先摊入药品成本,并组织各部门在虚高药价条件下,通过大肆贿赂医院、医生、医疗机构、医药相关协会组织等医药销售相关部门及其所属人员推销药品,牟取非法所得数十亿元。”“这些药品大多冠以海外原研药名义,在药品进口前通过转移定价的方式,增高药品报关价格,在将巨额利润预提在境外的基础上,设定高额销售成本用于支撑贿赂资金。药品的价格远高于在其他国家的价格,最高的达到其他国家的7倍。”[4] 虽然最后该案以30亿元人民币的高额罚金和四名高管被判刑而结案,但由此所揭露的医药行业黑幕还是让不少人寒心不已,顶级跨国大药企的人设都会崩塌,其它的呢?
在笔者看来,企业追求利润无可厚非。没有足够的利润,企业也很难有足够的动力继续研发新药。但药品毕竟是一种关系大众福祉的特殊商品,无论是自愿为之还是受到监管压力被迫为之,药企更应该在利润和社会责任之间找到平衡,而监管机构则应该发挥足够的作用来维持这种平衡。
仿制药是假药吗?
仿制药是指在一个制药企业的原研药的专利保护到期后,其他制药企业对原研药进行仿制的药品。仿制药与已上市的原研药具有相同的药物活性成分、剂型、安全性、效力、给药途径、质量、稳定性、作用特征和适应症。这些相同点有助于向监管机构证明仿制药与原研药具有相同的生物等效性,即仿制药与原研药品不仅以相同的方式在人体内工作,同时能取得相同的临床效果。此外,仿制药如果想要上市一样需要获得监管机构的批准。换句话说,我们可以把仿制药当作是原研药的替代品。因此,无论是法律意义还是疗效角度上看,仿制药都是“真药”。但是,如果一种在国外合法的仿制药未在我国获批就进口、销售的,按照法律规定均以“假药”论处,事实上多数国家也都有类似的药品管理法规。

图片来源:美国食品药品监督管理局(FDA)
为什么仿制药价格比原研药便宜?
仿制药是在原研药的基础上开发而来,其研发投入要比原研药低得多。但是,与原研药一样,仿制药的价格也从来不由其研发成本决定。美国FDA曾对1999-2004年期间美国本土销售的仿制药及相应原研药的价格做出调查,结果表明,[5] 第一个仿制药的价格不会比原研药低太多(在美国首仿药有180天的市场垄断权)。然而,当第二个仿制药出现时,该类仿制药的平均价格降低到原研药价格的近一半。随着更多仿制药的出现,价格会继续下跌,但速度较慢。对于能够吸引大量药企的仿制药产品来说,其最终价格可下降到原研药价格的20%,甚至更低。因此,当原研药的专利垄断期结束时,随之而来的激烈竞争自然会导致相应仿制药价格在原研药的基础上大幅下降,但一切都是以仿制药与品牌药一样可靠为前提。
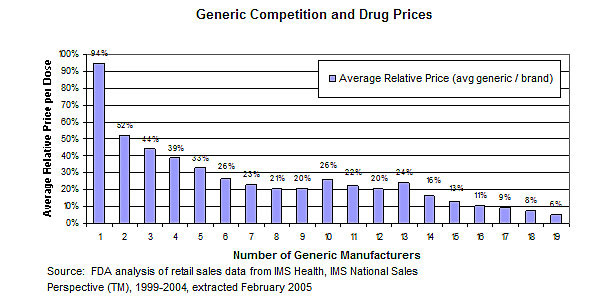
激烈的竞争导致仿制药的价格比原研药更便宜。图片来源:美国FDA
为什么中国人要买印度仿制药?
答案很简单,因为很多仿制药印度有而中国没有。为什么?通常情况下,为了保证原创药企的研究积极性、促进医药创新以及回收前期的研发投入,原研药都会申请专利保护,并能得到一定年限的市场垄断权,而仿制药的生产及上市则需要等到原研药专利过期之后。因此,如果某个原研药在中国境内申请了专利保护,那么在其专利保护期内,中国无法批准生产或进口相应的仿制药。而印度却可以通过其2005年前特有的专利法(只保护医药产品的生产方法)以及“强制专利许可”规则对尚在专利保护期的原研药进行“无节操”的仿制。
图片来自网络
说到这里,可能有人会问这种赤裸裸的侵犯知识产权的行为为什么没有受到制裁?有专门法律部门的跨国大药企在印度这么好欺负?而且中国的专利法中似乎也存在“强制专利许可”制度,为什么印度可以用而中国至今都没有用?这些问题超出了笔者的能力,太难回答了。但是,需要注意的是,印度正成为欧美制药企业在海外最大的药品“试验基地”,并且他们经常在很多病人不知情的情况下进行非法新药测试,造成了大量恶劣的后果。[6] 《印度时报》曾于2013年报道,在2007-2013年期间,有2644名印度人死于临床药物试验。而2015年的数据则显示,在2011-2015年期间,死于临床药物试验的印度人达到了2209个。当然,我们不能简单地将印度肆无忌惮的仿制行为和对欧美药企非法药品试验“睁一只眼闭一只眼”的做法画上等号,但是应当看到,国外制药巨头和印度政府在长年的对抗中,可能已经形成了某种默契,到了一种“井水不犯河水”的稳定局面。至于我国为什么没有启用“强制专利许可”制度,笔者认为其中可能牵涉很多的利益问题。
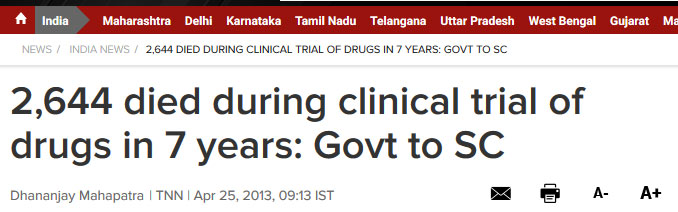
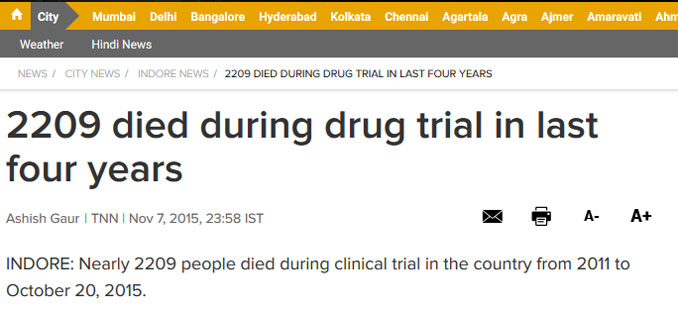
图片来源:《印度时报》(The Times of India)
中国的仿制药质量如何?
我国也是仿制药大国,化学药品市场几乎都是仿制药,在17万药品批准文号中,化学药品约有10.7万个,其中仿制药占比高达95%。然而作为仿制药生产和使用大国,长期以来我国的仿制药质量水平参差不齐,大多数仿制药都无法达到等同于相应原研药的临床效果,常常被诟病为“安全无效”的廉价仿制药。相比之下,同是发展中国家的印度,其仿制药水平远远超过我国。数据显示,截止到2015年,印度以太阳药业(SUN Pharma)为首的前10名制药企业总计获取FDA认证的仿制药申请(Abbrevitive New Drug Application,ANDA)1269项,其中作为全球第五大仿制药生产企业的SUN Pharma获批ANDA数量约占1/4,其在美国市场销售额占总收入的60%左右。同样是印度仿制药巨头的Dr. Reddy's,其仿制药在北美地区的收入占其仿制药收入的59%以上。仿制药在美国市场的销售已经成为印度企业的主要收入来源。而在我国,13家国际化进程上略有成效的制药企业获得ANDA生产许可的数量只有115项,还不到印度获批数量的1/10。[7]
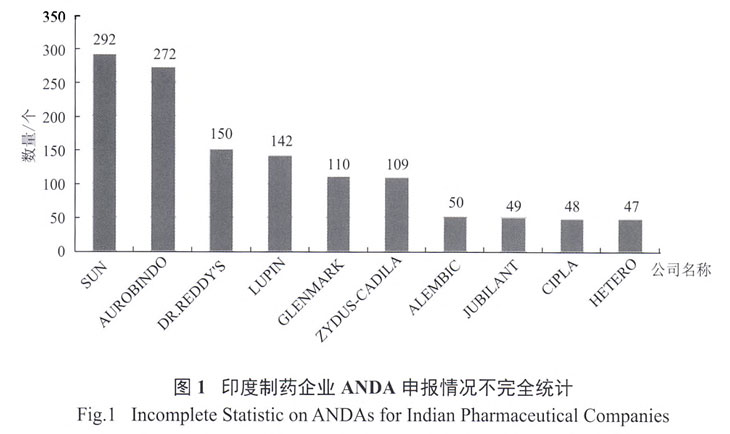
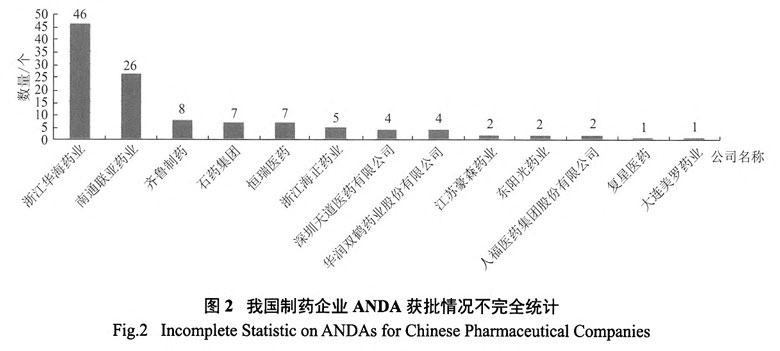
中国与印度获得FDA仿制药批准概况
为什么我国的仿制药水平上不去?
原因是多方面的。比如我国没有采用印度发展仿制药产业的制度,因此国内仿制药企业很难在同外资药企的竞争中获得原始资本的积累;病人对国产仿制药的质量存有疑虑,更倾向于选择原研药,医院也更愿意向患者推荐高价的原研药;仿制药招标过程中的“唯低价”论;我国的仿制药审批制度不完善,造成审批太慢,并且审批过程中对质量把控不过关等等。这些都导致国内药企没有动力、热情去做高质量的仿制药。当然,笔者认为最重要的原因之一,也是当下急需解决的问题是我国的仿制药生产领域长期以来缺乏高水平的质量标准。

印度仿制药巨头SUN Pharma
例如,仿制药在获批前需要提供给药品审批部门证明自己与相应原研药具有同等质量和疗效的证据——即仿制药质量一致性评价数据。通俗地说,就是要通过对照试验证明仿制药几乎等同于被仿制药。毫无疑问,对照制剂的选择是仿制药质量一致性评价的基础和源头,直接影响一致性评价结果的可靠性,如果方向从起点上就错了,不管多努力也只是在错误的路上越走越远。遗憾地是,我国相关部门长期以来都未能提供一份可让药企参考的符合要求的仿制药参比制剂目录,这导致药企在选择参比制剂时出现了“百家争鸣,百花齐放”的现象。例如,很多原研药在全球已经退市或没有在国内上市,根本无法获得(事实上,很多欧美企业以“限制分发”为由拒绝向仿制药企提供原样,以阻挠仿制药竞争对手进入市场),按理说就该选择其他国际上公认的同等药物,但是如何定义“国际公认”这四个字?——没有统一标准。最终的结果就是国内药企使用原研药的某种仿制药A作为参比制剂,而这种仿制药A获批时可能又是以仿制药B为参比制剂,结果导致误差积累,越仿越不像。此外,此外,长期以来,在一致性评价过程中哪些环节需要评价、选用什么方法开展评价等也一直没有严格的标准。
有了高质量的仿制药,原研药会大降价吗?
一部分人认为,随着高质量仿制药的上市,相应原研药价格也会大幅下降,然而事实并非如此。来自Bloomberg(全球商业、金融信息和财经资讯的领先提供商)的数据显示,从2005年到2016年,美国市场上原研药占全部处方药用量比例不断下降,从2005年的39.9%降至2016年的10.5%,然而在这11年间原研药占所有处方药销售额比例却仅仅下降了6.9%(81.1%到74.2%)。相比之下,销量比从60.1%大幅攀升至90%的仿制药,销售额占比涨幅还不足7%(18.9%到25.8%)。原研药企在销量大幅下降的情况下依然能保持强劲的收入,这说明美国的原研药价一直在持续上涨。另一份来自ASPE的报告显示,[8] 仿制药的年平均零售价格从2010年的551美元下降至2013年的283美元,而在此期间原研药的年平均零售价格却从2068美元上涨至2960美元。这意味着原研药与仿制药间的价格比从2010年的3.8:1拉大到2013年的10.5:1。尽管仿制药的进入会抢占一部分消费者,但是也有人对原研药“情有独钟”,他们对价格变化不太敏感,因此制药商可以毫无顾忌的提高药价,而不用担心客户的进一步流失。相较于完全竞争型的美国市场,中国目前的仿制药总体水平对原研药还无法构成威胁,即使面对一些高质量的仿制药的冲击,“过期”原研药在中国依然可以靠着“独特”的市场属性(例如很多原研药一降价就出现供应短缺,造成黑市价格上涨)来支撑其高昂价格。
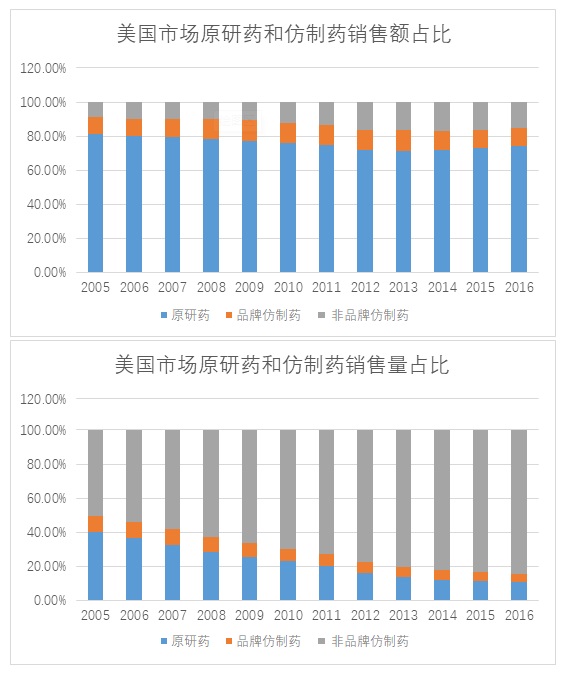
数据来源:Bloomberg
我们的病人是否用得上、用得起高质量的仿制药,既关系到能不能减轻患者负担、增加用药选择,关系到国民健康水平,也关系到医药行业健康发展。而要提高仿制药质量水平,必须得全链条入手,既要从研发生产上提高药品质量疗效,也要从制度上为仿制药的市场推广、供应保障铺路。相信随着近期一系列国家仿制药相关政策的出台,在大家的共同努力下,我们终会实现从仿制药大国到仿制药强国最终到创新药强国的跨越。
参考资料:
1. The High Cost of Preion Drugs in the United States Origins and Prospects for Reform. Journal of the American Medical Association, 2016, 316(8):858-871
2.《制药业的真相:一个2000亿美元的行业如何欺骗了我们》北京师范大学出版社
3. http://www.nbd.com.cn/articles/2018-07-10/1233598.html
4. http://www.mps.gov.cn/n2254098/n4904352/c4921030/content.html
5. https://www.fda.gov/aboutfda/centersoffices/officeofmedicalproductsandtobacco/cder/ucm129385.htm
6. 印度:西方药品的试验场?《中国经贸导刊》2004(5):46
7. 中印仿制药出海之路对比及对我国医药国际化的启示.《中国医药工业杂志》2018,49(5):690-697
8. https://aspe.hhs.gov/system/files/pdf/175071/GenericsDrugpaperr.pdf
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!










































 京公网安备 11010802027423号
京公网安备 11010802027423号