华东师范大学叶海峰课题组PNAS:新型光遗传学工具实现远红光控制细胞命运
国际著名学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America, PNAS)2018年7月2日在线发表了华东师范大学生命科学学院,上海市调控重点实验室研究员叶海峰(点击查看介绍)团队题为“Synthetic far-red light-mediated CRISPR-dCas9 device for inducing functional neuronal differentiation”的最新研究成果,叶海峰研究员为该研究论文的通讯作者,博士研究生邵佳伟(2016级)、副研究员王美艳和博士研究生余贵玲(2017级)为该研究论文的共同第一作者。
研究人员巧妙利用合成生物学、光遗传学、基因编辑、再生医学等多种技术手段,开发了远红光调控的CRISPR-dCas9内源基因转录激活装置(Far-red light (FRL)-activated CRISPR-dCas9 effector (FACE) device)。首次实现利用远红光操纵基因组基因的表达调控,建立了远红光调控内源基因表达的技术体系。利用该技术方法,研究人员实现了用远红光调控干细胞内源基因NEUROG2 的表达,从而控制干细胞分化为具有生物功能的神经细胞。该FACE系统可被广泛用于精准表观遗传调控或重编程,为研究内源基因组基因功能和转化医学提供强有力的技术支持。
随着哺乳动物合成生物学的飞速发展,诱导型基因环路被广泛应用于基因功能的研究、代谢性疾病、神经性疾病以及肿瘤的治疗。目前大多数诱导型基因环路只能诱导外源导入基因的表达而无法直接操纵内源基因组基因的表达。虽然研究者们已经开发出了蓝光调控的CRISPR-dCas9内源基因转录系统能操纵内源基因组基因的表达,但是由于蓝光具有较强的细胞毒性和组织穿透性弱等缺点,极大的限制了其在基因功能的研究和转化医学的应用。因此,为了克服这一缺点,叶海峰研究员领导的研究团队将CRISPR-dCas9和光遗传学这两大技术相结合,开发出了远红光调控的CRISPR-dCas9内源基因转录激活装置(FACE,见图1),该系统具有诱导倍数高、组织穿透力强、高度时空特异性以及低毒性等优点。
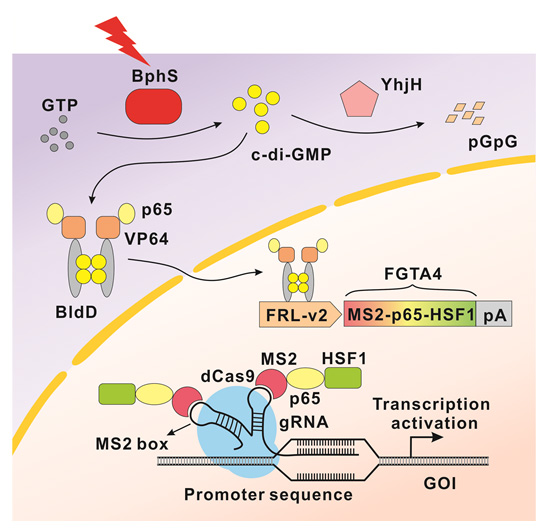
图1. 远红光控制的CRISPR-dCas9内源基因转录激活装置(FACE)。远红光诱导表达的转录激活子FGTA4(MS2-p65-HSF1) 与sgRNA/dCas9复合体相结合,在sgRNA/dCas9复合体靶向作用下,诱导下游内源基因的表达。
研究者们利用合成生物学的设计原理,将来自于红细菌中响应远红光的蛋白BphS、链球菌中的转录因子BldD、酿脓链球菌中的dCas9蛋白等经理性设计、组装合成远红光调控的CRISPR-dCas9内源基因转录激活装置(FACE,见图1),在远红光照射下,经sgRNA/dCas9的精准定位,能实现操控靶标基因上调表达的目的。
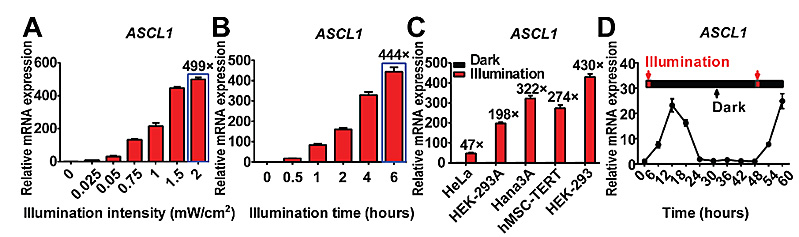
图2. 该FACE系统在细胞水平调控基因表达动力学特征。(A,B)FACE系统具有很好的光照强度和时间的依赖性。(C,D)FACE系统具有良好的广谱性和可逆性。
首先,研究者们在细胞水平测试了FACE系统的功能。研究证明FACE在远红光的诱导下,激活内源基因具有很好的光照强度和时间的依赖性、广谱性、可逆性(见图2)以及高度的时空特异性(见图3);研究者们还证明了FACE系统可以同时激活多个内源基因,且相互之间没有干扰,具有正交性(见图4),为研究基因组内源基因功能提供了强有力的技术手段。

图3. FACE系统的高度时空特异性。远红光时空调控表达绿色荧光蛋白,可以实现使用远红光在体外培养的单层细胞上任意写字。左图为远红光时空特异性装置示意图,右图为镂空ECNU字样的Photomask和远红光激活细胞表达绿色荧光蛋白结果图。
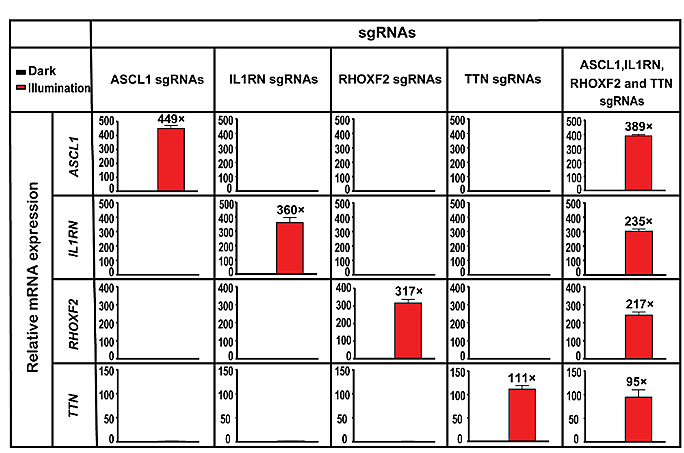
图4. 细胞水平证明该FACE系统可以同时激活多个内源基因,且相互之间没有干扰。
然后,研究者们将FACE装置通过电转导入小鼠后腿肌肉中,经远红光照射诱导后成功上调了小鼠肌肉中的Lmama1 和Fst 基因,实现表观遗传操控。而同等条件下,蓝光调控的CRISPR-dCas9内源基因转录系统(CPST2.0)则无法上调相应的基因表达(见图5)。证明了FACE系统具有更好的组织穿透力,展现出FACE系统在未来体内临床应用研究中的巨大潜力,为将来临床应用奠定了坚实的基础。
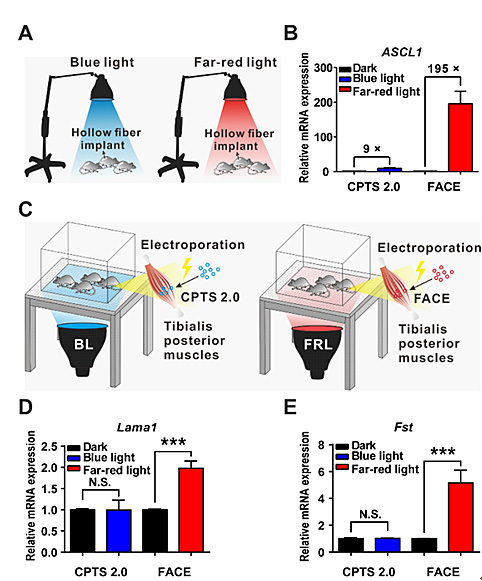
图5. 在小鼠体内验证FACE系统激活内源基因表达,实现表观遗传操控。
最后,研究者们将FACE装置导入诱导性多能干细胞(iPSCs)中,同时导入靶向内源基因的sgRNA,在远红光照射下能通过激活单个内源神经转录因子NEUROG2 将iPSC成功分化为功能性神经细胞。为精准可控的再生医学研究提供了一种新策略和方法。
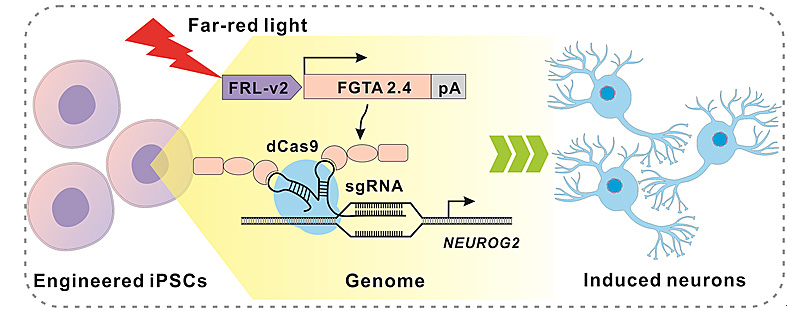
图6. FACE装置诱导诱导多能干细胞(iPSC)产生功能性神经细胞的设计示意图。
该研究首次在细胞水平和动物体内实现了利用远红光操控基因组内源基因的表达,并在远红光诱导下,成功地将iPSCs诱导分化为功能性神经细胞。这些研究进一步开拓了光遗传学工具箱,为哺乳动物细胞基因组的精密时空遗传调控的基础理论研究和转化应用研究奠定了基础,进一步促进了基于光遗传学的精准治疗和临床转化研究。

从左起分别为:本研究共同第一作者博士研究生邵佳伟、余贵玲、副研究员王美艳以及本研究通讯作者叶海峰研究员
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Jiawei Shao, Meiyan Wang, Guiling Yu, Sucheng Zhu, Yuanhuan Yu, Boon Chin Heng, Jiali Wu, and Haifeng Ye
Synthetic far-red light-mediated CRISPR-dCas9 device for inducing functional neuronal differentiation
PNAS, 2018, DOI: 10.1073/pnas.1802448115
通讯作者简介

叶海峰研究员于2007.8-2013.12在瑞士苏黎世联邦理工学院(ETH Zurich)从事博士和博士后研究工作。于2014年2月底回到母校华东师范大学受聘为“紫江优秀青年学者”,担任生命科学学院,上海市调控生物学重点实验室研究员、博士生导师。叶海峰研究员主要从事合成生物学与生物医学工程领域的研究。2015年获得国家自然科学基金委“优青”资助。叶海峰博士回国工作以来,带领自己的研究团队以通讯作者身份在Science Translational Medicine(封面文章)、Nature Biomedical Engineering、PNAS、Molecular Therapy 等高影响力杂志发表研究成果。主要研究内容包括:人工基因电路和定制细胞的设计与合成、光遗传学、精准可控基因编辑体系、代谢疾病智能诊疗、肿瘤免疫智能诊疗、合成生物学与再生医学、微生物合成生物学与疾病智能诊疗等。
该研究工作获得了国家自然科学基金委、国家科技部干细胞重大专项、上海市科委和华东师范大学人才队伍启动经费资助。
http://www.x-mol.com/university/faculty/40440
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号