糖尿病人的福星——不用打针的胰岛素,MOF作控释载体
糖尿病是一种常见的慢性代谢性疾病,如果不加控制,会对人体多个器官造成长期损伤,甚至还会造成死亡。胰岛素(Insulin)是一种蛋白质激素,可以控制血液中的血糖水平,注射胰岛素被广泛用于治疗糖尿病,特别是对于胰岛素抵抗(Insulin Resistance)的糖尿病患者。由于糖尿病需要长期治疗,日复一日的注射会给患者带来不小的肉体痛苦、精神压力和经济压力,相比之下,胰岛素口服药物就显得好接受的多。然而,胰岛素的本质是蛋白质,容易在胃肠道内被胃酸和消化酶降解,因此开发生物相容性的载体来运输胰岛素使其进入血液就成了研究的重点方向。目前,海藻酸盐微珠、纳米颗粒、纳米胶囊和胶原蛋白等都被用来作为载体包裹胰岛素,负载量可达到5-30 wt%。不过,要想达到希望的胰岛素浓度(100 IU/mL),往往要使用过量的载体,这难免引起其他一些不可预知的副作用。开发高胰岛素负载量的纳米载体,也就成为了目前亟待解决的问题。
近日,美国西北大学Omar K. Farha教授课题组找到了解决问题的新方法——那就是利用近年来火热的金属有机框架(MOF)材料。他们使用的是名为NU-1000的锆基多孔MOF材料,仅需30分钟胰岛素负载量可达约40 wt%。这种耐酸的MOF胶囊可以保护包裹其中的胰岛素不被胃酸和消化酶降解,并且,还可以在血液中可控释放出胰岛素。相关论文发表在J. Am. Chem. Soc. 杂志,博士生Yijing Chen和Peng Li博士是该文的共同第一作者。

Omar K. Farha教授。图片来源:Northwestern University
NU-1000是一种基于六核锆簇的介孔MOF。它的一维孔道拥有34 Å的孔径,由于锆簇跟羧酸配体的配位稳定性,这种MOF能在pH值1.5-3.5的胃酸里保持稳定。NU-1000材料的高比表面积可以更好吸附胰岛素,由于折叠的胰岛素大小约为13 Å × 34 Å ,可以很好地吸附于NU-1000的34 Å的孔道中(图1a)。在类似胃酸的酸性环境中,胰岛素被NU-1000的孔道所限制,无法大量去折叠,由此极大减少了胰岛素的降解。而胃中的胃蛋白酶(pepsin)由于体积太大,无法进入NU-1000载体,也就无法破坏包裹其中的胰岛素。一旦NU-1000包裹的胰岛素纳米胶囊被吸收进入血液,血液中的磷酸根离子会触发NU-1000的缓慢分解,从而实现胰岛素缓释(图1b)。
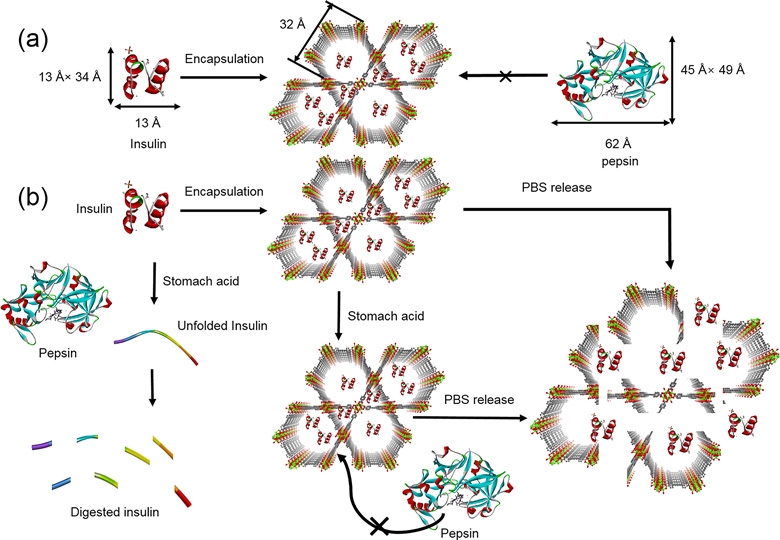
图1. (a)NU-1000包裹胰岛素示意图。胃蛋白酶由于体积太大不能进入NU-1000孔道。(b)NU-1000能够保护胰岛素免受胃中胃蛋白酶的破坏,而在血液中可以释放胰岛素。图片来源:J. Am. Chem. Soc.
作者将NU-1000晶体(长度2 μm)浸泡在胰岛素溶液中(4 × 10-4g/L)放置不同时间,通过UV-Vis光谱来检测上清液中残留的胰岛素浓度(图2a),从而算出负载量。仅需30分钟,上层清液中胰岛素就能基本被吸附完全(图2b),而且在MOF材料里达到40 wt%的负载量。这也创造了报道中的最高负载量记录。除了UV-Vis光谱,作者还使用了热重分析(TGA)和元素分析(ICP)表征,得到了相同结果。

图2. (a)不同浸泡时间上层清液中胰岛素UV-Vis光谱。(b)不同浸泡时间的上层清液中胰岛素含量。图片来源:J. Am. Chem. Soc.
接着,作者进一步表征了负载胰岛素的MOF(Insulin@NU-1000),并且分析了其于空载材料(NU-1000)的区别。图3a显示了Insulin@NU-1000与NU-1000在氮气吸附方面的不同。作为一种介孔材料,NU-1000表现出较高的氮气吸附能力。而Insulin@NU-1000由于孔道基本被胰岛素占据,吸附能力极大降低。从孔径分布上来看,NU-1000的孔道基本消失,也验证了孔道被占据的猜想(图3b)。粉末X-射线衍射(PXRD)显示NU-1000在负载胰岛素后,依然保持了良好的晶态(图3c)。通过扫描电镜(SEM)以及能量色散X-射线光谱分析(EDX)结果可以清晰表征出锆元素和硫元素(图3d)。由于硫元素是胰岛素的特征元素,这说明胰岛素在MOF材料中分布均匀。
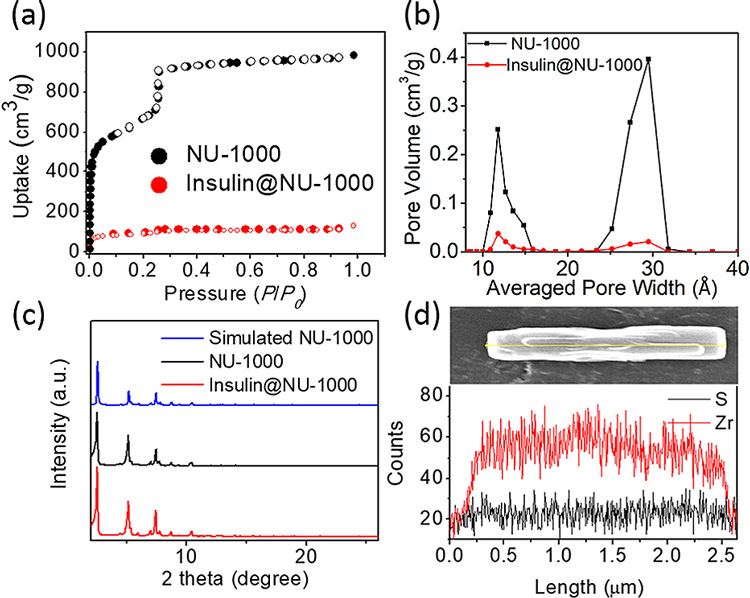
图3. (a)Insulin@NU-1000与NU-1000的氮气吸附。(b)Insulin@NU-1000与NU-1000的孔径分布。(c)Insulin@NU-1000与NU-1000的PXRD图,(d)Insulin@NU-1000的SEM以及EDX。图片来源:J. Am. Chem. Soc.
然后,作者研究了胰岛素从NU-1000中的可控释放。作者配置了胃酸溶液(pH = 1.29,相当于胃中的pH)和PBS溶液(pH = 7.0)(用来模拟血液环境)。接着将Insulin@NU-1000浸泡在两种溶液中,使用UV-Vis光谱来检测上清液中释放出来的胰岛素含量。在胃液环境中,60分钟后只有10%的胰岛素被释放出来,这表明NU-1000在这样的严苛环境下很好的保护了胰岛素。而在生理状态下NU-1000分解并释放胰岛素,一小时后达到了91%的释放量(图4a)。这样的结果实现了之前设计的血液可控释放的方式。为了验证胰岛素在经历酸性环境和类似血液的环境后还能保持生物活性,没有失活或者被分解,作者还使用了酶联免疫吸附法(ELISA)来验证释放后的胰岛素的活性。如同预期,如果胰岛素被直接暴露于胃酸,ELISA检测到胰岛素全部失活;而Insulin@NU-1000无论是直接暴露于PBS溶液,还是先暴露于胃酸溶液后暴露于PBS溶液,胰岛素依然保持活性。这些证据说明,NU-1000是一种可以保护胰岛素并只将胰岛素释放于血液中的优良高负载量载体。
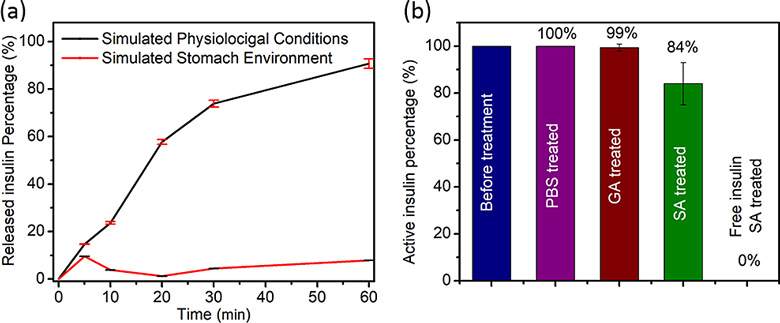
图4. (a)胃酸溶液和PBS溶液条件下,胰岛素从NU-1000中释放。(b)不同处理过程后胰岛素的活性。图片来源:J. Am. Chem. Soc.
——总结——
Omar K. Farha教授课题组通过使用耐酸性介孔MOF——NU-1000来负载胰岛素,通过MOF的稳定框架保护胰岛素免受胃酸和蛋白酶的降解,并且验证了MOF材料可以实现血液中的靶向释放功能。这一方法可能在未来开发出可靠的胰岛素口服药物,从而帮助糖尿病患者更容易方便地控制病情。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Acid-Resistant Mesoporous Metal−Organic Framework toward Oral Insulin Delivery: Protein Encapsulation, Protection, and Release
J. Am. Chem. Soc., 2018, 140, 5678−5681, DOI: 10.1021/jacs.8b02089
(本文由叶舞知秋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号