细胞质里做道场:Nat. Chem.报道手性有机金属催化剂的抗癌新方法
癌症,又称为恶性肿瘤,是一种严重威胁人类生命和健康的疾病。据世界卫生组织(WHO)报道,癌症是全球第二大死因,2015年导致880万人死亡,从全球情况看,近六分之一的死亡由癌症造成。[1] 虽然目前治疗癌症的药物已有几十种,但是由于癌症发病机理复杂,大多数药物也只能缓解病情。因此研究新型抗癌药物及其作用机制成为了化学、生物学及医学等领域的热点。与其他药物相比,金属药物具有独特的性质,以顺铂(PtCl2(NH3)2,cisplatin)为代表的铂类配合物在癌症治疗中发挥了巨大作用,目前超过50%的化疗治疗方案中都涉及铂类药物的使用,它们主要通过与DNA作用引起肿瘤细胞凋亡。但是铂类药物毒副作用大、易产生耐药性以及对一些肿瘤治疗无效,限制了其进一步的临床使用。因此,研发高效低毒、抗耐药的非铂类金属配合物引起了科学家的广泛关注。目前,研究较深入的非铂类抗肿瘤金属配合物包括Ru、Ir、Fe、Au、Ga、Os等金属化合物,其中不乏一些化合物具有较好的抗肿瘤活性,由于与铂类配合物结构差异较大,它们具有不同于顺铂的抗肿瘤机制,展现出良好的应用前景。
过渡金属Ru、Rh、Ir催化转移氢化反应是有机合成化学领域的研究热点。近年来,科学家发现这类金属可以作为转移氢化催化剂调控生物体内的活性氧(ROS)水平,利用癌细胞比正常细胞的抗氧化还原防御能力脆弱这一差异,选择性杀死癌细胞。例如英国华威大学Peter J. Sadler教授(点击查看介绍)等人发现具有半三明治结构的金属Ir(III)配合物可以催化细胞内NADH向NAD+转化,[2] 而金属Ru(II)配合物在氢给体甲酸的作用下可以催化细胞内NAD+向NADH转化,其抗癌机制可能涉及对癌细胞内的氧化还原系统和NADH调控的细胞信号通路的破坏。[3]
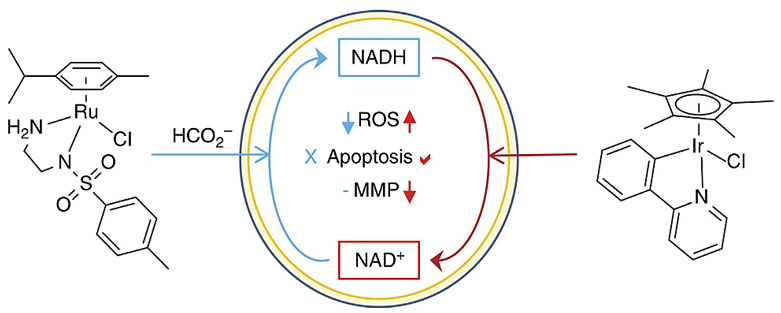
图1. 通过转移氢化反应策略杀伤癌细胞。图片来源:Nat. Commun. [3]
与铂类抗癌药物相比,这类催化剂性质的金属化合物作为抗癌药物的优势很明显:在很低剂量下就能产生很好的效果,副作用要少得多,而且其新颖的机理有利于对抗癌细胞的耐药性。基于类似策略,最近Peter Sadler教授等人以甲酸钠为氢供体,高度稳定的手性半三明治结构Os(II)配合物为催化剂,首次在细胞内实现了关键代谢中间体丙酮酸的不对称转移氢化反应。细胞实验证明,基于此催化机制可以实现癌细胞的选择性杀伤,对正常细胞的影响很小。相关成果发表在Nature Chemistry 上。

Peter Sadler教授。图片来源:University of Warwick
细胞内的化学环境十分复杂,一个催化剂要想在细胞中正常展现活性,首先就要有足够的稳定性。2015年,Peter Sadler教授等人就报道了金属Os(II)配合物催化芳香酮的不对称转移氢化反应,他们发现该类配合物可在磷酸缓冲溶液中稳定存在且不易分解,显示出其在细胞内进行催化不对称转移氢化反应的优势和潜力。[4]
如图2所示,研究者从芳烃配位的二氯化锇二聚体出发,以手性邻苯二胺为配体,利用高压微波反应和碱处理可快速高效合成N,N配体螯合的半三明治结构Os(II)配合物2-8。2-8在甲酸/三乙胺混合溶剂中催化苯乙酮还原反应,不仅能以优秀的对映选择性生成相应产物,且催化效率也要高于钌配合物9(图3)。细胞毒性实验显示2-8对人卵巢癌细胞株A2780增殖有一定抑制作用(IC50 = 4-30 μm),其中(R,R)-构型配体的配合物与其相应(S,S)-构型异构体的IC50值相近。在IC50浓度下,配合物2-8对A2780作用24小时后,细胞内Os累积量可达到4.8-31.9 ng Os×106 cells。构效关系研究表明这类配合物的抗增殖活性受其疏水性影响,疏水性越强,肿瘤细胞对配合物摄取率越大,抑制活性越高。作者进一步研究了Os(II)配合物2在A2780癌细胞内的分布情况以及抗增殖机制,结果表明Os主要富集在细胞质(47±2%)和细胞膜/细胞器上(48±3%),可以将细胞周期阻滞在G1期,但不会诱导细胞凋亡,也不破坏细胞膜的完整性。以上实验结果表明,Os(II)配合物2具有高稳定性、高催化效率(TOF = 63.9±0.3 h-1)、较低细胞毒性(IC50 = 15.5±0.5 μm)、高细胞摄取率(30±2 ng Os×106 cells)等优点,这意味着Os(II)配合物2可以在细胞质中达到能启动催化的较高浓度,同时又不会导致细胞死亡,也就意味着有希望使用Os(II)配合物2为催化剂在细胞内开展不对称转移氢化反应研究。
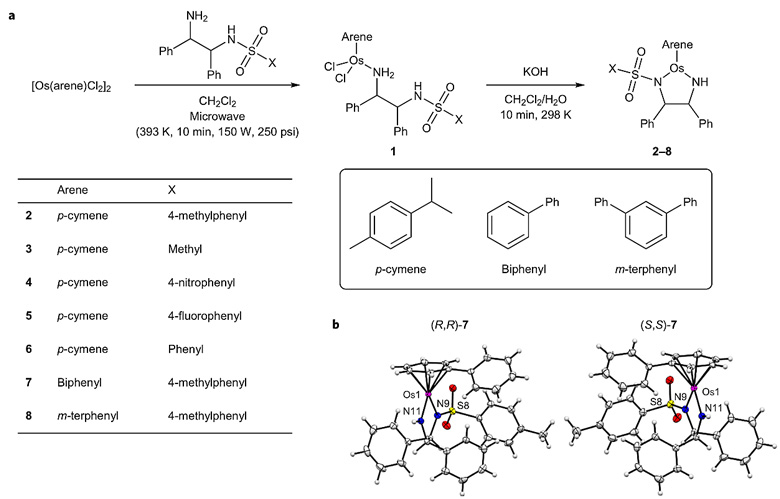
图2. Os(II)配合物2-8的合成。图片来源:Nat. Chem.

图3. 苯乙酮的还原反应及Os(II)配合物对A2780的抗增殖活性。图片来源:Nat. Chem.
丙酮酸是细胞糖代谢及体内多种物质相互转化的重要中间体,对于需要快速增殖的癌细胞来说非常关键。因此,在细胞内进行丙酮酸氢化一方面可以打乱癌细胞对能量和关键代谢物的控制,另外一方面还可以破坏癌细胞内脆弱的氧化还原平衡,进而选择性杀伤癌细胞。
研究者首先在磷酸缓冲液中测试了Os(II)配合物2对丙酮酸不对称转移氢化的催化活性。以甲酸钠(4 mM)为氢源,Os(II)配合物2(10 μM)为催化剂,丙酮酸钠(2 mM)在磷酸缓冲液中的不对称转移氢化反应可以顺利发生,反应转化速率受甲酸钠用量的影响,将甲酸钠浓度由4 mM增加至30 mM时,反应转化速率提升近10倍。反应对映选择性也很好,使用(R,R)-2可得到D-乳酸盐(83% e.e.),(S,S)-2可得到L-乳酸盐(84% ee)。
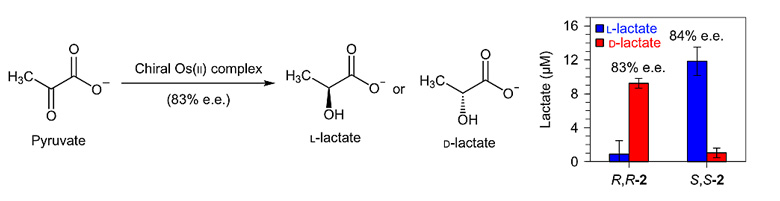
图4. 磷酸缓冲液中丙酮酸的不对称氢化。图片来源:Nat. Chem.
随后他们在含有Os(II)配合物2或7的细胞培养液中加入甲酸钠,对卵巢癌细胞(A2780)以及正常细胞卵巢成纤维细胞(HOF)和肺成纤维细胞(MRC5)进行试验。结果表明甲酸钠的加入可大幅增加Os(II)配合物2对A2780的抗增殖活性,并且活性随着甲酸钠浓度的升高而明显增强,最高可提升约13倍。Os(II)配合物7的结果类似。值得一提的是甲酸钠的加入并没有影响细胞对Os(II)配合物2或7的摄取率。正常细胞的实验结果让人惊喜,Os(II)配合物加甲酸钠的组合并没有对细胞产生明显的影响(图5c/d),这证明了这种策略的确对癌细胞有选择性。当使用乙酸钠代替甲酸钠时,配合物2对A2780的抗增殖活性基本没有变化,这可能和乙酸钠无法作为氢供体有关(图5b)。他们还发现N-甲酰蛋氨酸(fMet)可以提高配合物2和7对前列腺癌细胞PC3的抗增殖活性,原因可能在于PC3中的肽脱甲酰化酶(PDF)可将fMet水解并产生甲酸盐。在使用N-乙酰蛋氨酸时,这种情况并不发生,因为N-乙酰蛋氨酸水解只能生成乙酸盐,无法作为氢供体。同样的规律也在Os(II)配合物7上被发现。
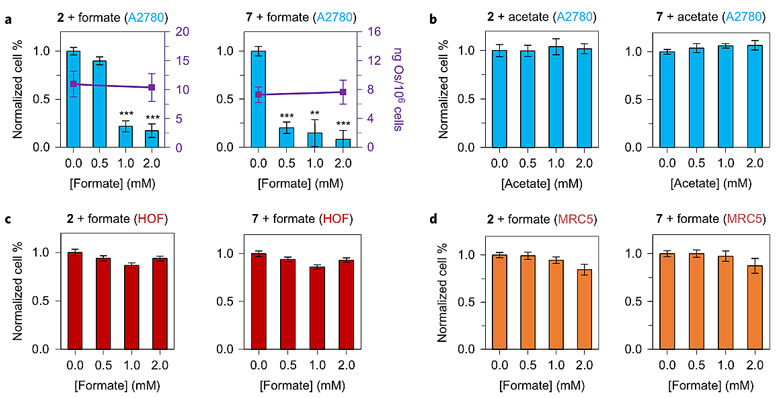
图5. Os(II)配合物2和7在不同条件下对A2780、HOF和MRC5的抗增殖活性。图片来源:Nat. Chem.
以上结果表明,Os(II)配合物对癌细胞抗增殖活性的提高很可能与涉及Os(II)配合物/甲酸钠的转移氢化反应有关。通常,细胞内乳酸脱氢酶可催化丙酮酸生成L-乳酸,D-乳酸在细胞中也存在,但浓度很低。研究者于是检测了不同条件下A2780细胞和培养液中D-乳酸盐的浓度,发现在(R,R)-2和甲酸钠存在条件下,细胞内D-乳酸盐的浓度明显升高,升高幅度大于(S,S)-2和甲酸钠的组合,而且对于细胞外的D-乳酸盐浓度,无论是(R,R)-2还是(S,S)-2在甲酸钠存在条件下都没有表现出明显影响(图6)。这确证了转移氢化反应在细胞内发生,并且具有高对映选择性。
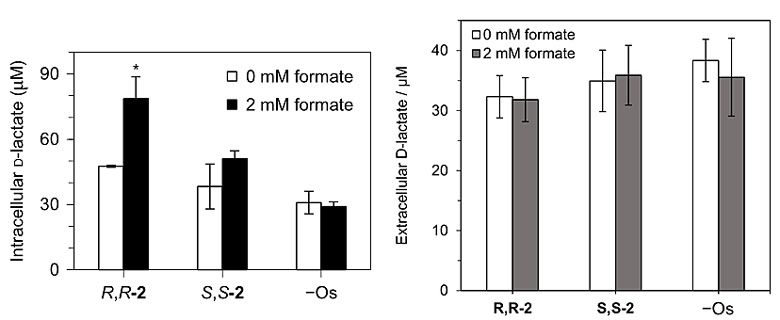
图6. 不同条件下细胞内和细胞外的D-乳酸盐浓度。图片来源:Nat. Chem.
研究者初步探索了Os(II)配合物2/甲酸钠对A2780癌细胞的抗增殖机制。同Os(II)配合物2单独作用于A2780细胞类似,Os(II)配合物2/甲酸钠体系也没有诱导细胞凋亡和破坏膜的完整性。细胞周期实验显示分裂后的细胞被阻滞在G1期的数量有所增加,但并不明显,也就是说在Os(II)配合物2/甲酸钠作用下,A2780细胞G1期的阻滞效应仅稍微增强。这些都表明甲酸钠的加入并没有改变Os(II)配合物2的作用机制,只是增强了这种机制,而这种机制研究者认为与细胞生长抑制有关。由于Os(II)配合物2在细胞核上富集较少,并且没有出现S/G2M期阻滞,其抗增殖机制也并不涉及DNA作用机理。
——总结——
Peter Sadler教授等人首次实现了细胞内丙酮酸的不对称转移氢化反应。该反应以无毒剂量的甲酸钠为氢源,高度稳定的手性Os(II)配合物为催化剂,将丙酮酸还原成两种不同构型的乳酸,并可选择性杀死癌细胞,其作用机制可能在于影响癌细胞的代谢和氧化还原平衡。虽然丙酮酸还原产生乳酸并不太可能是癌细胞死亡的直接原因,但这一工作为癌症治疗找到了新的细胞靶点,值得进一步展开研究。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric transfer hydrogenation by synthetic catalysts in cancer cells
Nat. Chem., 2018, DOI: 10.1038/NCHEM.2918
导师介绍
Peter Sadler
http://www.x-mol.com/university/faculty/7044
参考文献:
1. http://www.who.int/mediacentre/factsheets/fs297/zh/
2. Liu, Z. et al. The potent oxidant anticancer activity of organoiridium catalysts. Angew. Chem. Int. Ed., 2014, 53, 3941-3946
3. Soldevila-Barreda, J. J., Romero-Canelón, I., Habtemariam, A. & Sadler, P. J. Transfer hydrogenation catalysis in cells as a new approach to anticancer drug design. Nat. Commun., 2015, 6, 6582
4. Coverdale, J. P. C. et al. Easy to synthesize, robust organo–osmium asymmetric transfer hydrogenation catalysts. Chem. Eur. J., 2015, 21, 8043-8046
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号