Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Evolution-guided engineering of non-heme iron enzymes involved in nogalamycin biosynthesis.
The FEBS Journal ( IF 5.5 ) Pub Date : 2019-12-26 , DOI: 10.1111/febs.15192 Benjamin Nji Wandi 1 , Vilja Siitonen 1 , Pedro Dinis 1 , Vladimir Vukic 2, 3 , Tiina A Salminen 2 , Mikko Metsä-Ketelä 1
The FEBS Journal ( IF 5.5 ) Pub Date : 2019-12-26 , DOI: 10.1111/febs.15192 Benjamin Nji Wandi 1 , Vilja Siitonen 1 , Pedro Dinis 1 , Vladimir Vukic 2, 3 , Tiina A Salminen 2 , Mikko Metsä-Ketelä 1
Affiliation
|
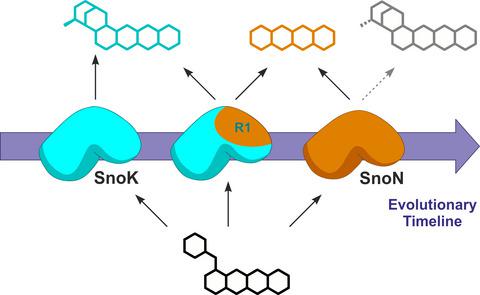
Microbes are competent chemists that are able to generate thousands of chemically complex natural products with potent biological activities. The key to the formation of this chemical diversity has been the rapid evolution of secondary metabolism. Many enzymes residing on these metabolic pathways have acquired atypical catalytic properties in comparison with their counterparts found in primary metabolism. The biosynthetic pathway of the anthracycline nogalamycin contains two such proteins, SnoK and SnoN, belonging to nonheme iron and 2‐oxoglutarate‐dependent mono‐oxygenases. In spite of structural similarity, the two proteins catalyze distinct chemical reactions; SnoK is a C2–C5″ carbocyclase, whereas SnoN catalyzes stereoinversion at the adjacent C4″ position. Here, we have identified four structural regions involved in the functional differentiation and generated 30 chimeric enzymes to probe catalysis. Our analyses indicate that the carbocyclase SnoK is the ancestral form of the enzyme from which SnoN has evolved to catalyze stereoinversion at the neighboring carbon. The critical step in the appearance of epimerization activity has likely been the insertion of three residues near the C‐terminus, which allow repositioning of the substrate in front of the iron center. The loss of the original carbocyclization activity has then occurred with changes in four amino acids near the iron center that prohibit alignment of the substrate for the formation of the C2–C5″ bond. Our study provides detailed insights into the evolutionary processes that have enabled Streptomyces soil bacteria to become the major source of antibiotics and antiproliferative agents.
中文翻译:

诺加霉素生物合成中涉及的非血红素铁酶的进化指导工程。
微生物是能干的化学家,能够产生具有强大生物活性的数千种化学复杂的天然产物。形成这种化学多样性的关键是次级代谢的迅速发展。与主要代谢中发现的酶相比,这些代谢途径中的许多酶具有非典型的催化特性。蒽环霉素土霉素的生物合成途径包含两个这样的蛋白质,SnoK和SnoN,它们属于非血红素铁和依赖于2-氧戊二酸的单加氧酶。尽管结构相似,但这两种蛋白催化不同的化学反应。SnoK是一种C2-C5”碳环化酶,而SnoN则在相邻的C4”位置催化立体倒置。这里,我们已经确定了参与功能分化的四个结构区域,并产生了30种嵌合酶来探测催化作用。我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解链霉菌成为土壤细菌的主要来源,是抗生素和抗增殖剂。
更新日期:2019-12-26
中文翻译:

诺加霉素生物合成中涉及的非血红素铁酶的进化指导工程。
微生物是能干的化学家,能够产生具有强大生物活性的数千种化学复杂的天然产物。形成这种化学多样性的关键是次级代谢的迅速发展。与主要代谢中发现的酶相比,这些代谢途径中的许多酶具有非典型的催化特性。蒽环霉素土霉素的生物合成途径包含两个这样的蛋白质,SnoK和SnoN,它们属于非血红素铁和依赖于2-氧戊二酸的单加氧酶。尽管结构相似,但这两种蛋白催化不同的化学反应。SnoK是一种C2-C5”碳环化酶,而SnoN则在相邻的C4”位置催化立体倒置。这里,我们已经确定了参与功能分化的四个结构区域,并产生了30种嵌合酶来探测催化作用。我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 我们的分析表明,碳环化酶SnoK是该酶的祖先形式,SnoN已从该酶进化而来,以催化邻近碳的立体转化。出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 出现差向异构活性的关键步骤可能是在C末端附近插入了三个残基,这些残基允许将底物重新定位在铁中心的前面。然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解 然后,铁中心附近的四个氨基酸发生变化,导致最初的碳环化活性丧失,从而阻止了用于C2-C5''键形成的底物对齐。我们的研究提供了对促成进化过程的详细见解链霉菌成为土壤细菌的主要来源,是抗生素和抗增殖剂。











































 京公网安备 11010802027423号
京公网安备 11010802027423号