当前位置:
X-MOL 学术
›
Bioconjugate Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Site-Specific Protein Photochemical Covalent Attachment to Carbon Nanotube Side Walls and Its Electronic Impact on Single Molecule Function.
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2020-01-07 , DOI: 10.1021/acs.bioconjchem.9b00719 Suzanne K Thomas 1 , W David Jamieson 2 , Rebecca E A Gwyther 3 , Benjamin J Bowen 3 , Adam Beachey 1 , Harley L Worthy 3 , J Emyr Macdonald 1 , Martin Elliott 1 , Oliver K Castell 2 , D Dafydd Jones 3
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2020-01-07 , DOI: 10.1021/acs.bioconjchem.9b00719 Suzanne K Thomas 1 , W David Jamieson 2 , Rebecca E A Gwyther 3 , Benjamin J Bowen 3 , Adam Beachey 1 , Harley L Worthy 3 , J Emyr Macdonald 1 , Martin Elliott 1 , Oliver K Castell 2 , D Dafydd Jones 3
Affiliation
|
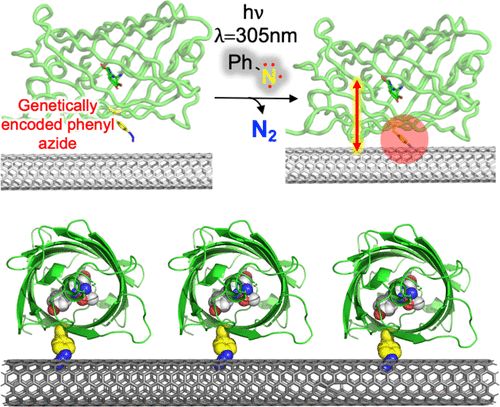
Functional integration of proteins with carbon-based nanomaterials such as nanotubes holds great promise in emerging electronic and optoelectronic applications. Control over protein attachment poses a major challenge for consistent and useful device fabrication, especially when utilizing single/few molecule properties. Here, we exploit genetically encoded phenyl azide photochemistry to define the direct covalent attachment of four different proteins, including the fluorescent protein GFP and a β-lactamase binding protein (BBP), to carbon nanotube side walls. AFM showed that on attachment BBP could still recognize and bind additional protein components. Single molecule fluorescence revealed that on attachment to SWCNTs function was retained and there was feedback to GFP in terms of fluorescence intensity and improved resistance to photobleaching; GFP is fluorescent for much longer on attachment. The site of attachment proved important in terms of electronic impact on GFP function, with the attachment site furthest from the chromophore having the larger effect on fluorescence. Our approach provides a versatile and general method for generating intimate protein-CNT hybrid bioconjugates. It can be potentially applied to any protein of choice; the attachment position and thus interface characteristics with the CNT can easily be changed by simply placing the phenyl azide chemistry at different residues by gene mutagenesis. Thus, our approach will allow consistent construction and modulate functional coupling through changing the protein attachment position.
中文翻译:

位点特异性蛋白质光化学共价附着到碳纳米管侧壁及其对单分子功能的电子影响。
蛋白质与碳基纳米材料(如纳米管)的功能整合在新兴的电子和光电子应用中具有很大的前景。对蛋白质附着的控制对一致和有用的设备制造提出了重大挑战,尤其是在利用单分子/少分子特性时。在这里,我们利用基因编码的苯基叠氮化物光化学来定义四种不同蛋白质(包括荧光蛋白 GFP 和 β-内酰胺酶结合蛋白 (BBP))与碳纳米管侧壁的直接共价连接。AFM 表明,在附着时,BBP 仍然可以识别和结合其他蛋白质成分。单分子荧光显示,在附着于 SWCNT 时,功能得以保留,并且在荧光强度和提高的抗光漂白性方面对 GFP 有反馈;GFP 在附着时发出荧光的时间要长得多。事实证明,附着位点对 GFP 功能的电子影响很重要,离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。
更新日期:2020-01-07
中文翻译:

位点特异性蛋白质光化学共价附着到碳纳米管侧壁及其对单分子功能的电子影响。
蛋白质与碳基纳米材料(如纳米管)的功能整合在新兴的电子和光电子应用中具有很大的前景。对蛋白质附着的控制对一致和有用的设备制造提出了重大挑战,尤其是在利用单分子/少分子特性时。在这里,我们利用基因编码的苯基叠氮化物光化学来定义四种不同蛋白质(包括荧光蛋白 GFP 和 β-内酰胺酶结合蛋白 (BBP))与碳纳米管侧壁的直接共价连接。AFM 表明,在附着时,BBP 仍然可以识别和结合其他蛋白质成分。单分子荧光显示,在附着于 SWCNT 时,功能得以保留,并且在荧光强度和提高的抗光漂白性方面对 GFP 有反馈;GFP 在附着时发出荧光的时间要长得多。事实证明,附着位点对 GFP 功能的电子影响很重要,离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。离发色团最远的附着位点对荧光的影响更大。我们的方法提供了一种通用且通用的方法来生成紧密的蛋白质-CNT 杂化生物偶联物。它可以潜在地应用于任何选择的蛋白质;通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。通过简单地通过基因诱变将苯基叠氮化物化学放置在不同的残基上,可以很容易地改变附着位置以及与 CNT 的界面特性。因此,我们的方法将通过改变蛋白质附着位置来实现一致的构建和调节功能耦合。











































 京公网安备 11010802027423号
京公网安备 11010802027423号