Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ubiquitin release from eL40 is required for cytoplasmic maturation and function of 60S ribosomal subunits in Saccharomyces cerevisiae.
The FEBS Journal ( IF 5.5 ) Pub Date : 2019-07-25 , DOI: 10.1111/febs.14999 Sara Martín-Villanueva 1, 2 , Antonio Fernández-Pevida 1, 2 , José Fernández-Fernández 1, 2 , Dieter Kressler 3 , Jesús de la Cruz 1, 2
The FEBS Journal ( IF 5.5 ) Pub Date : 2019-07-25 , DOI: 10.1111/febs.14999 Sara Martín-Villanueva 1, 2 , Antonio Fernández-Pevida 1, 2 , José Fernández-Fernández 1, 2 , Dieter Kressler 3 , Jesús de la Cruz 1, 2
Affiliation
|
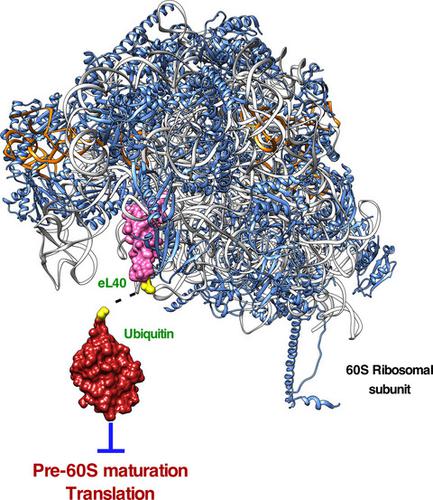
Ubiquitin is generated by proteolytic cleavage of precursor proteins in which it is fused either to itself, constituting a linear polyubiquitin protein of head-to-tail monomers, or as a single N-terminal moiety to one of two ribosomal proteins, eL40 (Ubi1/2 precursors) and eS31 (Ubi3 precursor). It has been proposed that the ubiquitin moiety fused to these ribosomal proteins could act as a chaperone by facilitating their efficient production, folding and ribosome assembly in Saccharomyces cerevisiae. We have previously shown that ubiquitin release from eS31 is required for yeast viability and that noncleaved Ubi3 can get incorporated into translation-competent 40S subunits. In this study, we have analysed the effects of mutations that partially or totally impair cleavage of the ubiquitin-eL40A fusion protein. While noncleaved Ubi1 is not able to support growth when it is the sole cellular source of eL40, it can assemble into nascent pre-60S particles. However, Ubi1-containing 60S ribosomal subunits are not competent for translation. This is likely due to a steric interference of the unprocessed ubiquitin with the binding and function of factors that interact with the ribosome's GTPase-associated centre. In agreement with this suggestion, Ubi1-containing ribosomes affect the efficient recycling of the anti-association factor Tif6 and have a reduced presence of translation elongation factors. We conclude that the removal of the ubiquitin moiety from ribosomal protein eL40 is an essential prerequisite for both the cytoplasmic maturation and the functionality of 60S ribosomal subunits.
中文翻译:

酿酒酵母中,从eL40释放泛素对于细胞质成熟和60S核糖体亚基的功能是必需的。
泛素是通过蛋白水解切割前体蛋白而产生的,前体蛋白与自身融合,构成头尾单体的线性多聚泛素蛋白,或者作为两个核糖体蛋白之一eL40的单个N末端部分(Ubi1 / 2个前体)和eS31(Ubi3前体)。已经提出,与这些核糖体蛋白融合的遍在蛋白部分可以通过促进它们在酿酒酵母中的有效生产,折叠和核糖体组装而充当分子伴侣。先前我们已经证明,从eS31释放泛素对于酵母的生存能力是必需的,并且未切割的Ubi3可以整合到具有翻译能力的40S亚基中。在这项研究中,我们分析了部分或全部损害泛素-eL40A融合蛋白裂解的突变的影响。当未裂解的Ubi1是eL40的唯一细胞来源时,它不能支持生长,但它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。含Ubi1的核糖体影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。
更新日期:2020-01-21
中文翻译:

酿酒酵母中,从eL40释放泛素对于细胞质成熟和60S核糖体亚基的功能是必需的。
泛素是通过蛋白水解切割前体蛋白而产生的,前体蛋白与自身融合,构成头尾单体的线性多聚泛素蛋白,或者作为两个核糖体蛋白之一eL40的单个N末端部分(Ubi1 / 2个前体)和eS31(Ubi3前体)。已经提出,与这些核糖体蛋白融合的遍在蛋白部分可以通过促进它们在酿酒酵母中的有效生产,折叠和核糖体组装而充当分子伴侣。先前我们已经证明,从eS31释放泛素对于酵母的生存能力是必需的,并且未切割的Ubi3可以整合到具有翻译能力的40S亚基中。在这项研究中,我们分析了部分或全部损害泛素-eL40A融合蛋白裂解的突变的影响。当未裂解的Ubi1是eL40的唯一细胞来源时,它不能支持生长,但它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。它可以组装成新生的60S以前的颗粒。但是,包含Ubi1的60S核糖体亚基不能胜任翻译。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。这可能是由于未加工的遍在蛋白与与核糖体的GTPase相关中心相互作用的因子的结合和功能发生了空间干扰。与此建议一致,含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。含Ubi1的核糖体影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。含Ubi1的核糖体会影响抗缔合因子Tif6的有效循环,并减少翻译延伸因子的存在。我们得出的结论是,从核糖体蛋白eL40去除泛素部分是细胞质成熟和60S核糖体亚基功能的必不可少的前提。











































 京公网安备 11010802027423号
京公网安备 11010802027423号