当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Dynamics and Allosteric Information Pathways of Unphosphorylated c-Cbl
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-11-28 , DOI: 10.1021/acs.jcim.2c01022 Tianyi Yang 1 , Li Han 2 , Shuanghong Huo 1
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-11-28 , DOI: 10.1021/acs.jcim.2c01022 Tianyi Yang 1 , Li Han 2 , Shuanghong Huo 1
Affiliation
|
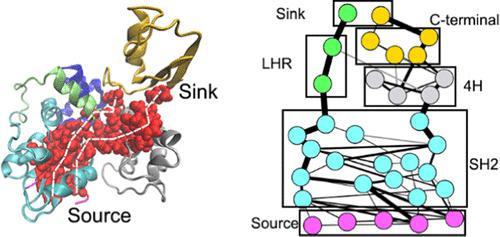
Human c-Cbl is a RING-type ligase and plays a central role in the protein degradation cascade. To elucidate its conformational changes related to substrate binding, we performed molecular dynamics simulations of different variants/states of c-Cbl for a cumulative time of 68 μs. Our simulations demonstrate that before the substrate binds, the RING domain samples a broad set of conformational states at a biologically relevant salt concentration, including the closed, partially open, and fully open states, whereas substrate binding leads to a restricted conformational sampling. Phe378 and the C-terminal region play an essential role in stabilizing the partially open state. To visualize the allosteric signal transmission pathways from the substrate-binding site to the 40 Å apart RING domain and identify the critical residues for allostery, we have created a subgraph from the optimal and suboptimal paths. Redundant paths are seen in the SH2 domain where the substrate binds, while the major bottlenecks are found at the junction between the SH2 domain and the linker helix region as well as that between the SH2 domain and the 4H bundle. These bottlenecks separate the paths into two overall routes. The nodes/residues at the bottlenecks on the subgraph are considered allosteric hot spots. This subgraph approach provides a general tool for network visualization and determination of critical residues for allostery. The structurally and allosterically critical residues identified in our work are testable and would provide valuable insights into the emerging strategies for drug discovery, such as targeted protein degradation.
中文翻译:

未磷酸化 c-Cbl 的动力学和变构信息通路
人 c-Cbl 是一种 RING 型连接酶,在蛋白质降解级联中起着核心作用。为了阐明其与底物结合相关的构象变化,我们对 c-Cbl 的不同变体/状态进行了分子动力学模拟,累计时间为 68 μs。我们的模拟表明,在底物结合之前,RING 域在生物学相关的盐浓度下对一组广泛的构象状态进行采样,包括闭合、部分打开和完全打开状态,而底物结合导致构象采样受限。Phe378 和 C 端区域在稳定部分开放状态方面起着至关重要的作用。为了可视化从底物结合位点到相距 40 Å 的 RING 结构域的变构信号传输途径,并确定变构的关键残基,我们已经从最优和次优路径创建了一个子图。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。
更新日期:2022-11-28
中文翻译:

未磷酸化 c-Cbl 的动力学和变构信息通路
人 c-Cbl 是一种 RING 型连接酶,在蛋白质降解级联中起着核心作用。为了阐明其与底物结合相关的构象变化,我们对 c-Cbl 的不同变体/状态进行了分子动力学模拟,累计时间为 68 μs。我们的模拟表明,在底物结合之前,RING 域在生物学相关的盐浓度下对一组广泛的构象状态进行采样,包括闭合、部分打开和完全打开状态,而底物结合导致构象采样受限。Phe378 和 C 端区域在稳定部分开放状态方面起着至关重要的作用。为了可视化从底物结合位点到相距 40 Å 的 RING 结构域的变构信号传输途径,并确定变构的关键残基,我们已经从最优和次优路径创建了一个子图。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。在底物结合的 SH2 结构域中可以看到冗余路径,而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。而主要的瓶颈出现在 SH2 结构域和接头螺旋区域之间的连接处以及 SH2 结构域和 4H 束之间的连接处。这些瓶颈将路径分成两条总路线。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。子图瓶颈处的节点/残基被认为是变构热点。这种子图方法为网络可视化和确定变构的关键残基提供了一个通用工具。在我们的工作中确定的结构和变构关键残基是可测试的,并将为药物发现的新兴策略提供有价值的见解,例如靶向蛋白质降解。











































 京公网安备 11010802027423号
京公网安备 11010802027423号