Computational and Structural Biotechnology Journal ( IF 4.4 ) Pub Date : 2022-11-08 , DOI: 10.1016/j.csbj.2022.11.010 Evianne Rovers 1 , Lihua Liu 1 , Matthieu Schapira 1, 2
|
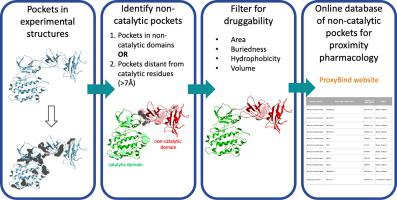
Proximity-induced pharmacology (ProxPharm) is a novel paradigm in drug discovery where a small molecule brings two proteins in close proximity to elicit a signal, generally from one protein onto another. The potential of ProxPharm compounds as a new therapeutic modality is firmly established by proteolysis targeting chimeras (PROTACs) that bring an E3 ubiquitin ligase in proximity to a target protein to induce ubiquitination and subsequent degradation of the target. The concept can be expanded to induce other post-translational modifications via the recruitment of different types of protein-modifying enzymes. To survey the human proteome for opportunities in proximity pharmacology, we systematically mapped non-catalytic drug binding pockets on the structure of protein-modifying enzymes available from the Protein Databank. In addition to binding sites exploited by previously reported ProxPharm compounds, we identified putative ligandable non-catalytic pockets in 236 kinases, 45 phosphatases, 37 deubiquitinases, 14 methyltransferases, 11 acetyltransferases, 13 glycosyltransferases, 4 deacetylases, 7 demethylases and 2 glycosidases, including cavities occupied by chemical matter that may serve as starting points for future ProxPharm compounds. This systematic survey confirms that proximity pharmacology is a versatile modality with largely unexplored and promising potential and reveals novel opportunities to pharmacologically rewire molecular circuitries. All data is available from the ProxyBind database at https://polymorph.sgc.utoronto.ca/proxybind/index.php.
中文翻译:

ProxyBind:接近诱导药理学的结合位点纲要
接近诱导药理学 (ProxPharm) 是药物发现中的一种新范例,其中小分子使两种蛋白质非常接近以引发信号,通常是从一种蛋白质到另一种蛋白质。ProxPharm 化合物作为一种新治疗方式的潜力是通过蛋白水解靶向嵌合体 (PROTAC) 确定的,该嵌合体将 E3 泛素连接酶带到靶蛋白附近,以诱导泛素化和随后的靶标降解。这个概念可以扩展到通过招募不同类型的蛋白质修饰酶来诱导其他翻译后修饰。为了调查人类蛋白质组以寻找接近药理学的机会,我们系统地绘制了蛋白质数据库中可用的蛋白质修饰酶结构上的非催化药物结合口袋。除了先前报道的 ProxPharm 化合物利用的结合位点外,我们还在 236 种激酶、45 种磷酸酶、37 种去泛素化酶、14 种甲基转移酶、11 种乙酰转移酶、13 种糖基转移酶、4 种脱乙酰酶、7 种脱甲基酶和 2 种糖苷酶中鉴定了推定的可配体非催化口袋,包括空腔被化学物质占据,可以作为未来 ProxPharm 化合物的起点。这项系统性调查证实,接近药理学是一种多才多艺的模式,具有很大的未开发和有前途的潜力,并揭示了药理学重新连接分子电路的新机会。所有数据都可以从 https://polymorph.sgc.utoronto.ca/proxybind/index.php 的 ProxyBind 数据库中获得。我们在 236 种激酶、45 种磷酸酶、37 种去泛素化酶、14 种甲基转移酶、11 种乙酰转移酶、13 种糖基转移酶、4 种去乙酰化酶、7 种去甲基化酶和 2 种糖苷酶中鉴定了假定的可配体非催化口袋,包括被化学物质占据的空腔,这些空腔可以作为未来的起点ProxPharm 化合物。这项系统性调查证实,接近药理学是一种多才多艺的模式,具有很大的未开发和有前途的潜力,并揭示了药理学重新连接分子电路的新机会。所有数据都可以从 https://polymorph.sgc.utoronto.ca/proxybind/index.php 的 ProxyBind 数据库中获得。我们在 236 种激酶、45 种磷酸酶、37 种去泛素化酶、14 种甲基转移酶、11 种乙酰转移酶、13 种糖基转移酶、4 种去乙酰化酶、7 种去甲基化酶和 2 种糖苷酶中鉴定了假定的可配体非催化口袋,包括被化学物质占据的空腔,这些空腔可以作为未来的起点ProxPharm 化合物。这项系统性调查证实,接近药理学是一种多才多艺的模式,具有很大的未开发和有前途的潜力,并揭示了药理学重新连接分子电路的新机会。所有数据都可以从 https://polymorph.sgc.utoronto.ca/proxybind/index.php 的 ProxyBind 数据库中获得。包括被化学物质占据的空腔,这些空腔可以作为未来 ProxPharm 化合物的起点。这项系统性调查证实,接近药理学是一种多才多艺的模式,具有很大的未开发和有前途的潜力,并揭示了药理学重新连接分子电路的新机会。所有数据都可以从 https://polymorph.sgc.utoronto.ca/proxybind/index.php 的 ProxyBind 数据库中获得。包括被化学物质占据的空腔,这些空腔可以作为未来 ProxPharm 化合物的起点。这项系统性调查证实,接近药理学是一种多才多艺的模式,具有很大的未开发和有前途的潜力,并揭示了药理学重新连接分子电路的新机会。所有数据都可以从 https://polymorph.sgc.utoronto.ca/proxybind/index.php 的 ProxyBind 数据库中获得。











































 京公网安备 11010802027423号
京公网安备 11010802027423号