当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Molecular Insights into the Heterotropic Allosteric Mechanism in Cytochrome P450 3A4-Mediated Midazolam Metabolism
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-11-07 , DOI: 10.1021/acs.jcim.2c01264 Tingting Fu 1 , Hongxing Zhang 1 , Qingchuan Zheng 1, 2
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2022-11-07 , DOI: 10.1021/acs.jcim.2c01264 Tingting Fu 1 , Hongxing Zhang 1 , Qingchuan Zheng 1, 2
Affiliation
|
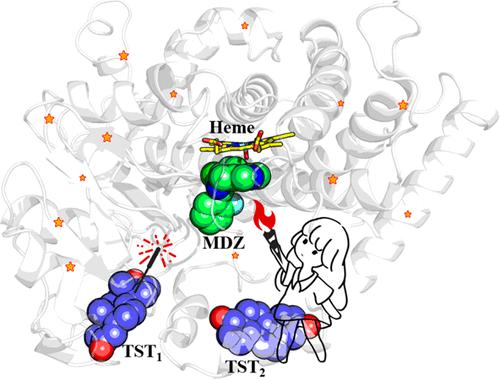
Cytochrome P450 3A4 (CYP3A4) is the main P450 enzyme for drug metabolism and drug–drug interactions (DDIs), as it is involved in the metabolic process of approximately 50% of drugs. A detailed mechanistic elucidation of DDIs mediated by CYP3A4 is commonly believed to be critical for drug optimization and rational use. Here, two typical probes, midazolam (MDZ, substrate) and testosterone (TST, allosteric effector), are used to investigate the molecular mechanism of CYP3A4-mediated heterotropic allosteric interactions, through conventional molecular dynamics (cMD) and well-tempered metadynamics (WT-MTD) simulations. Distance monitoring shows that TST can stably bind in two potential peripheral sites (Site 1 and Site 2) of CYP3A4. The binding of TST at these two sites can induce conformational changes in CYP3A4 flexible loops on the basis of conformational analysis, thereby promoting the transition of the MDZ binding mode and affecting the ratio of MDZ metabolites. According to the results of the residue interaction network, multiple allosteric communication pathways are identified that can provide vivid and applicable insights into the heterotropic allostery of TST on MDZ metabolism. Comparing the regulatory effects and the communication pathways, the allosteric effect caused by TST binding in Site 2 seems to be more pronounced than in Site 1. Our findings could provide a deeper understanding of CYP3A4-mediated heterotropic allostery at the atomic level and would be helpful for rational drug use as well as the design of new allosteric modulators.
中文翻译:

细胞色素 P450 3A4 介导的咪达唑仑代谢中异性变构机制的分子洞察
细胞色素 P450 3A4 (CYP3A4) 是药物代谢和药物-药物相互作用 (DDI) 的主要 P450 酶,因为它参与了大约 50% 药物的代谢过程。通常认为,对 CYP3A4 介导的 DDI 的详细机制阐明对于药物优化和合理使用至关重要。在这里,两种典型的探针,咪达唑仑(MDZ,底物)和睾酮(TST,变构效应物)用于通过常规分子动力学(cmD)和良好回火的元动力学(WT)研究CYP3A4介导的异性变构相互作用的分子机制-MTD) 模拟。距离监测显示 TST 可以稳定地结合在 CYP3A4 的两个潜在外围位点(站点 1 和站点 2)。TST在这两个位点的结合可以在构象分析的基础上诱导CYP3A4柔性环的构象变化,从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。
更新日期:2022-11-07
中文翻译:

细胞色素 P450 3A4 介导的咪达唑仑代谢中异性变构机制的分子洞察
细胞色素 P450 3A4 (CYP3A4) 是药物代谢和药物-药物相互作用 (DDI) 的主要 P450 酶,因为它参与了大约 50% 药物的代谢过程。通常认为,对 CYP3A4 介导的 DDI 的详细机制阐明对于药物优化和合理使用至关重要。在这里,两种典型的探针,咪达唑仑(MDZ,底物)和睾酮(TST,变构效应物)用于通过常规分子动力学(cmD)和良好回火的元动力学(WT)研究CYP3A4介导的异性变构相互作用的分子机制-MTD) 模拟。距离监测显示 TST 可以稳定地结合在 CYP3A4 的两个潜在外围位点(站点 1 和站点 2)。TST在这两个位点的结合可以在构象分析的基础上诱导CYP3A4柔性环的构象变化,从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。从而促进MDZ结合方式的转变,影响MDZ代谢物的比例。根据残基相互作用网络的结果,确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。确定了多个变构通讯途径,可以为 TST 对 MDZ 代谢的异向变构提供生动和适用的见解。比较调节效应和通讯途径,位点 2 中 TST 结合引起的变构效应似乎比位点 1 中更明显。我们的研究结果可以在原子水平上更深入地了解 CYP3A4 介导的异性变构,并将有所帮助用于合理用药以及设计新的变构调节剂。











































 京公网安备 11010802027423号
京公网安备 11010802027423号