当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Tachykinin Neuropeptides and Amyloid β (25–35) Assembly: Friend or Foe?
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-08-02 , DOI: 10.1021/jacs.2c03845 Xikun Liu 1 , Pritam Ganguly 1 , Yingying Jin 1 , Michael J Jhatro 1 , Joan-Emma Shea 1 , Steven K Buratto 1 , Michael T Bowers 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2022-08-02 , DOI: 10.1021/jacs.2c03845 Xikun Liu 1 , Pritam Ganguly 1 , Yingying Jin 1 , Michael J Jhatro 1 , Joan-Emma Shea 1 , Steven K Buratto 1 , Michael T Bowers 1
Affiliation
|
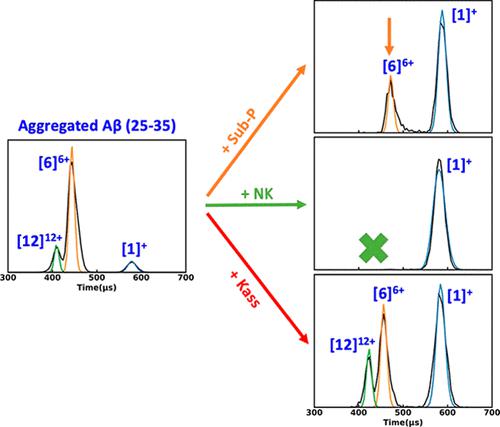
Amyloid β (Aβ) protein is responsible for Alzheimer’s disease, and one of its important fragments, Aβ(25–35), is found in the brain and has been shown to be neurotoxic. Tachykinin neuropeptides, including Neuromedin K (NK), Kassinin, and Substance P, have been reported to reduce Aβ(25–35)’s toxicity in cells even though they share similar primary structures with Aβ(25–35). Here, we seek to understand the molecular mechanisms of how these peptides interact with Aβ(25–35) and to shed light on why some peptides with similar primary structures are toxic and others nontoxic. We use both experimental and computational methods, including ion mobility mass spectrometry and enhanced-sampling replica-exchange molecular dynamics simulations, to study the aggregation pathways of Aβ(25–35), NK, Kassinin, Substance P, and mixtures of the latter three with Aβ(25–35). NK and Substance P were observed to remove the higher-order oligomers (i.e., hexamers and dodecamers) of Aβ(25–35), which are related to its toxicity, although Substance P did so more slowly. In contrast, Kassinin was found to promote the formation of these higher-order oligomers. This result conflicts with what is expected and is elaborated on in the text. We also observe that even though they have significant structural homology with Aβ(25–35), NK, Kassinin, and Substance P do not form hexamers with a β-sheet structure like Aβ(25–35). The hexamer structure of Aβ(25–35) has been identified as a cylindrin, and this structure has been strongly correlated to toxic species. The reasons why the three tachykinin peptides behave so differently when mixed with Aβ(25–35) are discussed.
中文翻译:

速激肽神经肽和淀粉样蛋白 β (25–35) 组装:朋友还是敌人?
淀粉样蛋白 β (Aβ) 是导致阿尔茨海默病的原因,其重要片段之一 Aβ(25-35) 存在于大脑中,已被证明具有神经毒性。据报道,速激肽神经肽,包括 Neuromedin K (NK)、Kassinin 和 P 物质,可降低 Aβ(25-35) 在细胞中的毒性,尽管它们与 Aβ(25-35) 具有相似的一级结构。在这里,我们试图了解这些肽如何与 Aβ(25-35) 相互作用的分子机制,并阐明为什么一些具有相似一级结构的肽是有毒的而另一些是无毒的。我们使用实验和计算方法,包括离子迁移质谱和增强采样复制交换分子动力学模拟,来研究 Aβ(25-35)、NK、Kassinin、P 物质的聚集途径,以及后三种与Aβ(25-35)的混合物。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Aβ(25-35)的六聚体和十二聚体),这与其毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Aβ(25-35)的六聚体和十二聚体),这与其毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Kassinin 被发现可以促进这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Kassinin 被发现可以促进这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。和物质 P 不形成具有 β-折叠结构的六聚体,如 Aβ(25-35)。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。和物质 P 不形成具有 β-折叠结构的六聚体,如 Aβ(25-35)。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。
更新日期:2022-08-02
中文翻译:

速激肽神经肽和淀粉样蛋白 β (25–35) 组装:朋友还是敌人?
淀粉样蛋白 β (Aβ) 是导致阿尔茨海默病的原因,其重要片段之一 Aβ(25-35) 存在于大脑中,已被证明具有神经毒性。据报道,速激肽神经肽,包括 Neuromedin K (NK)、Kassinin 和 P 物质,可降低 Aβ(25-35) 在细胞中的毒性,尽管它们与 Aβ(25-35) 具有相似的一级结构。在这里,我们试图了解这些肽如何与 Aβ(25-35) 相互作用的分子机制,并阐明为什么一些具有相似一级结构的肽是有毒的而另一些是无毒的。我们使用实验和计算方法,包括离子迁移质谱和增强采样复制交换分子动力学模拟,来研究 Aβ(25-35)、NK、Kassinin、P 物质的聚集途径,以及后三种与Aβ(25-35)的混合物。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。NK 和物质 P 被观察到去除 Aβ(25-35) 的高阶寡聚体(即六聚体和十二聚体),这与它的毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Aβ(25-35)的六聚体和十二聚体),这与其毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Aβ(25-35)的六聚体和十二聚体),这与其毒性有关,尽管物质 P 的作用较慢。相比之下,发现 Kassinin 促进了这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Kassinin 被发现可以促进这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。Kassinin 被发现可以促进这些高阶低聚物的形成。该结果与预期结果相冲突,并在文本中进行了详细说明。我们还观察到,尽管它们与 Aβ(25-35)、NK、Kassinin 和物质 P 具有显着的结构同源性,但它们不会像 Aβ(25-35) 那样形成具有 β-折叠结构的六聚体。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。和物质 P 不形成具有 β-折叠结构的六聚体,如 Aβ(25-35)。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。和物质 P 不形成具有 β-折叠结构的六聚体,如 Aβ(25-35)。Aβ(25-35) 的六聚体结构已被确定为圆柱体,并且这种结构与有毒物种密切相关。讨论了三种速激肽与 Aβ(25-35) 混合时表现如此不同的原因。










































 京公网安备 11010802027423号
京公网安备 11010802027423号