当前位置:
X-MOL 学术
›
ACS Environ. Au
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Complementary Structural Information for Antibody–Antigen Complexes from Hydrogen–Deuterium Exchange and Covalent Labeling Mass Spectrometry
ACS Environmental Au Pub Date : 2022-06-15 , DOI: 10.1021/jasms.2c00108 Catherine Y. Tremblay 1 , Zachary J. Kirsch 1 , Richard W. Vachet 1
ACS Environmental Au Pub Date : 2022-06-15 , DOI: 10.1021/jasms.2c00108 Catherine Y. Tremblay 1 , Zachary J. Kirsch 1 , Richard W. Vachet 1
Affiliation
|
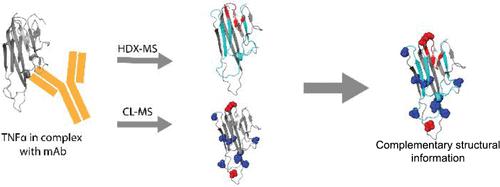
Characterizing antibody–antigen interactions is necessary for properly developing therapeutic antibodies, understanding their mechanisms of action, and patenting new drug molecules. Here, we demonstrate that hydrogen–deuterium exchange (HDX) mass spectrometry (MS) measurements together with diethylpyrocarbonate (DEPC) covalent labeling (CL) MS measurements provide higher order structural information about antibody–antigen interactions that is not available from either technique alone. Using the well-characterized model system of tumor necrosis factor α (TNFα) in complex with three different monoclonal antibodies (mAbs), we show that two techniques offer a more complete overall picture of TNFα’s structural changes upon binding different mAbs, sometimes providing synergistic information about binding sites and changes in protein dynamics upon binding. Labeling decreases in CL generally occur near the TNFα epitope, whereas decreases in HDX can span the entire protein due to substantial stabilization that occurs when mAbs bind TNFα. Considering both data sets together clarifies the TNFα regions that undergo a decrease in solvent exposure due to mAb binding and that undergo a change in dynamics due to mAb binding. Moreover, the single-residue level resolution of DEPC-CL/MS can clarify HDX/MS data for long peptides. We feel that the two techniques should be used together when studying the mAb–antigen interactions because of the complementary information they provide.
中文翻译:

来自氢-氘交换和共价标记质谱法的抗体-抗原复合物的补充结构信息
表征抗体-抗原相互作用对于正确开发治疗性抗体、了解其作用机制和为新药分子申请专利是必要的。在这里,我们证明了氢-氘交换 (HDX) 质谱 (MS) 测量与焦碳酸二乙酯 (DEPC) 共价标记 (CL) MS 测量一起提供了有关抗体-抗原相互作用的更高阶结构信息,这两种技术都无法获得。使用肿瘤坏死因子 α (TNFα) 与三种不同单克隆抗体 (mAb) 复合的充分表征的模型系统,我们表明两种技术提供了 TNFα 在结合不同 mAb 后结构变化的更完整的整体图景,有时提供有关结合位点和结合后蛋白质动力学变化的协同信息。CL 的标记减少通常发生在 TNFα 表位附近,而 HDX 的减少可以跨越整个蛋白质,因为当 mAb 结合 TNFα 时会发生显着稳定。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。而 HDX 的降低可以跨越整个蛋白质,因为当 mAb 与 TNFα 结合时会发生显着的稳定性。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。而 HDX 的降低可以跨越整个蛋白质,因为当 mAb 与 TNFα 结合时会发生显着的稳定性。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。
更新日期:2022-06-15
中文翻译:

来自氢-氘交换和共价标记质谱法的抗体-抗原复合物的补充结构信息
表征抗体-抗原相互作用对于正确开发治疗性抗体、了解其作用机制和为新药分子申请专利是必要的。在这里,我们证明了氢-氘交换 (HDX) 质谱 (MS) 测量与焦碳酸二乙酯 (DEPC) 共价标记 (CL) MS 测量一起提供了有关抗体-抗原相互作用的更高阶结构信息,这两种技术都无法获得。使用肿瘤坏死因子 α (TNFα) 与三种不同单克隆抗体 (mAb) 复合的充分表征的模型系统,我们表明两种技术提供了 TNFα 在结合不同 mAb 后结构变化的更完整的整体图景,有时提供有关结合位点和结合后蛋白质动力学变化的协同信息。CL 的标记减少通常发生在 TNFα 表位附近,而 HDX 的减少可以跨越整个蛋白质,因为当 mAb 结合 TNFα 时会发生显着稳定。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。而 HDX 的降低可以跨越整个蛋白质,因为当 mAb 与 TNFα 结合时会发生显着的稳定性。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。而 HDX 的降低可以跨越整个蛋白质,因为当 mAb 与 TNFα 结合时会发生显着的稳定性。将这两个数据集一起考虑可以阐明由于 mAb 结合而导致溶剂暴露减少以及由于 mAb 结合而发生动态变化的 TNFα 区域。此外,DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。DEPC-CL/MS 的单残留水平分辨率可以澄清长肽的 HDX/MS 数据。我们认为这两种技术在研究 mAb-抗原相互作用时应该一起使用,因为它们提供了互补的信息。



























 京公网安备 11010802027423号
京公网安备 11010802027423号