当前位置:
X-MOL 学术
›
J. Pept. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Methionine-associated peptide α-amidation is directed both to the N- and the C-terminal amino acids
Journal of Peptide Science ( IF 1.8 ) Pub Date : 2022-06-13 , DOI: 10.1002/psc.3429 Johann Sajapin 1 , Annemarie Kulas 1 , Michael Hellwig 1, 2
Journal of Peptide Science ( IF 1.8 ) Pub Date : 2022-06-13 , DOI: 10.1002/psc.3429 Johann Sajapin 1 , Annemarie Kulas 1 , Michael Hellwig 1, 2
Affiliation
|
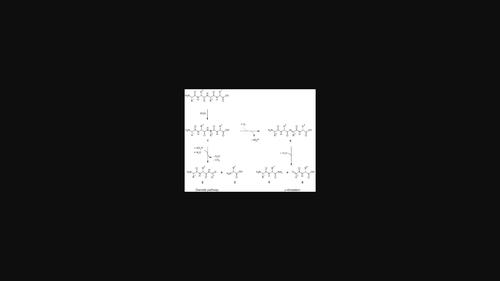
Peptide-bound methionine may transfer oxidative damage from the thioether side chain to the peptide backbone, catalyzing decomposition in general and α-amidation in particular. In the present study, we focused on the reactivity and reaction pathways of peptides. We synthesized model peptides comprising methionine or not and investigated their overall tendency towards decomposition and formation of specific products under conditions mimicking the cooking process at 100°C in buffered solution (pH 6.0) in the presence of redox-active substances such as transition metal ions and reductones. Peptides containing methionine were more susceptible to α-amidation under all oxidative conditions, and the products of N-terminus-directed α-amidation were quantified. Exemplarily, after incubation in the presence of cupric sulfate, about 2.0 mol-% of the overall decomposition of Z-glycylmethionylglycine accounted for the formation of Z-glycinamide, whereas it was below 0.1 mol-% for Z-glycylalanylglycine. Surprisingly and different from previous observations, C-terminus-directed α-amidation was observed for the first time. From Z-glycylmethionylglycine, the respective products were formed in higher amounts than the N-terminus-directed α-amidation product Z-glycinamide under all applied oxidation conditions. The preference of electron transfer from the amino nitrogen bound in the peptide bond directed to the C-terminus may be ascribed to a sterically less demanding hexagonal 3-electron-2-center intermediate during methionine-catalyzed α-amidation.
中文翻译:

蛋氨酸相关肽 α-酰胺化作用于 N 端和 C 端氨基酸
肽结合的蛋氨酸可以将氧化损伤从硫醚侧链转移到肽主链,通常催化分解,特别是 α-酰胺化。在本研究中,我们专注于肽的反应性和反应途径。我们合成了包含或不包含蛋氨酸的模型肽,并研究了它们在模拟 100°C 缓冲溶液 (pH 6.0) 中在氧化还原活性物质(如过渡金属离子)存在下的烹饪过程的条件下分解和形成特定产物的总体趋势和还原酮。在所有氧化条件下,含有蛋氨酸的肽对 α-酰胺化更敏感,并且对 N 末端定向的 α-酰胺化产物进行了量化。示例性地,在硫酸铜存在下孵育后,约 2。Z-甘氨酰甲硫氨酰甘氨酸的总分解量的 0 mol-% 导致了 Z-甘氨酰胺的形成,而 Z-甘氨酰丙氨酰甘氨酸低于 0.1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。Z-甘氨酰丙氨酰甘氨酸为 1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。Z-甘氨酰丙氨酰甘氨酸为 1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。在所有应用的氧化条件下,相应产物的形成量均高于 N 末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。在所有应用的氧化条件下,相应产物的形成量均高于 N 末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。
更新日期:2022-06-13
中文翻译:

蛋氨酸相关肽 α-酰胺化作用于 N 端和 C 端氨基酸
肽结合的蛋氨酸可以将氧化损伤从硫醚侧链转移到肽主链,通常催化分解,特别是 α-酰胺化。在本研究中,我们专注于肽的反应性和反应途径。我们合成了包含或不包含蛋氨酸的模型肽,并研究了它们在模拟 100°C 缓冲溶液 (pH 6.0) 中在氧化还原活性物质(如过渡金属离子)存在下的烹饪过程的条件下分解和形成特定产物的总体趋势和还原酮。在所有氧化条件下,含有蛋氨酸的肽对 α-酰胺化更敏感,并且对 N 末端定向的 α-酰胺化产物进行了量化。示例性地,在硫酸铜存在下孵育后,约 2。Z-甘氨酰甲硫氨酰甘氨酸的总分解量的 0 mol-% 导致了 Z-甘氨酰胺的形成,而 Z-甘氨酰丙氨酰甘氨酸低于 0.1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。Z-甘氨酰丙氨酰甘氨酸为 1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。Z-甘氨酰丙氨酰甘氨酸为 1 mol-%。令人惊讶的是,与之前的观察结果不同,首次观察到 C 末端定向的 α-酰胺化。在所有应用的氧化条件下,从 Z-甘氨酰甲硫氨酰甘氨酸中形成的相应产物的量均高于 N-末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。在所有应用的氧化条件下,相应产物的形成量均高于 N 末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。在所有应用的氧化条件下,相应产物的形成量均高于 N 末端定向的 α-酰胺化产物 Z-甘氨酰胺。电子从结合在肽键中的氨基氮向 C 末端转移的偏好可能归因于在蛋氨酸催化的 α-酰胺化过程中空间上要求较低的六方 3-电子-2-中心中间体。











































 京公网安备 11010802027423号
京公网安备 11010802027423号