Redox Biology ( IF 10.7 ) Pub Date : 2021-10-14 , DOI: 10.1016/j.redox.2021.102167 Mingxia Bi 1 , Xixun Du 1 , Xue Xiao 1 , Yingying Dai 1 , Qian Jiao 1 , Xi Chen 1 , Lingqiang Zhang 2 , Hong Jiang 1
|
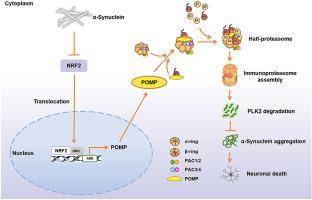
Aberrant α-synuclein (α-Syn) accumulation resulting from proteasome dysfunction is considered as a prominent factor to initiate and aggravate the neurodegeneration in Parkinson's disease (PD). Although the involvement of 26S proteasome in proteostasis imbalance has been widely accepted, our knowledge about the regulation of immunoproteasome function and its potential role in α-Syn pathology remains limited. Immunoproteasome abundance and proteolytic activities depend on the finely tuned assembly process, especially β-ring formation mediated by the only well-known chaperone proteasome maturation protein (POMP). Here, we identified that α-Syn overexpression was associated with a reduction in immunoproteasome function, which in turn limited the degradation of polo-like kinase 2 (PLK2), exacerbated α-Syn Ser129 phosphorylation and aggregation, ultimately leading to the neurodegeneration. These effects could be dramatically attenuated by β5i overexpression. Mechanistically, α-Syn suppressed the transcriptional regulation of POMP by nuclear factor erythroid 2-related factor 2 (NRF2), thereby preventing the assembly of immunoproteasome β subunits. Dopaminergic neurons-specific overexpression of NRF2-POMP axis effectively rescued the aggregation of α-Syn and PD-like phenotypes. These findings characterized abnormal immunoproteasome assembly as a key contributor governing α-Syn accumulation and neurodegeneration, which might open up a new perspective for the implication of immunoproteasome in PD and provide approaches of manipulating immunoproteasome assembly for therapeutic purposes.
中文翻译:

免疫蛋白酶体组装缺陷导致帕金森病中 α-突触核蛋白病理学的增加
蛋白酶体功能障碍导致的异常 α-突触核蛋白 (α-Syn) 积累被认为是引发和加重帕金森病 (PD) 神经退行性变的重要因素。尽管 26S 蛋白酶体参与蛋白质稳态失衡已被广泛接受,但我们对免疫蛋白酶体功能调节及其在 α-Syn 病理学中的潜在作用的了解仍然有限。免疫蛋白酶体丰度和蛋白水解活性取决于微调的组装过程,尤其是由唯一众所周知的伴侣蛋白酶体成熟蛋白 (POMP) 介导的 β 环形成。在这里,我们发现 α-Syn 过表达与免疫蛋白酶体功能的降低有关,这反过来又限制了 polo 样激酶 2 (PLK2) 的降解,加剧了 α-Syn Ser129 的磷酸化和聚集,最终导致神经退化。β5i 过表达可以显着减弱这些影响。从机制上讲,α-Syn 抑制了核因子红细胞 2 相关因子 2 (NRF2) 对 POMP 的转录调节,从而阻止了免疫蛋白酶体 β 亚基的组装。NRF2-POMP 轴的多巴胺能神经元特异性过表达有效地挽救了 α-Syn 和 PD 样表型的聚集。这些发现将异常的免疫蛋白酶体组装描述为控制 α-Syn 积累和神经变性的关键因素,这可能为免疫蛋白酶体在 PD 中的意义开辟了新的视角,并提供了为治疗目的操纵免疫蛋白酶体组装的方法。β5i 过表达可以显着减弱这些影响。从机制上讲,α-Syn 抑制了核因子红细胞 2 相关因子 2 (NRF2) 对 POMP 的转录调节,从而阻止了免疫蛋白酶体 β 亚基的组装。NRF2-POMP 轴的多巴胺能神经元特异性过表达有效地挽救了 α-Syn 和 PD 样表型的聚集。这些发现将异常的免疫蛋白酶体组装描述为控制 α-Syn 积累和神经变性的关键因素,这可能为免疫蛋白酶体在 PD 中的意义开辟了新的视角,并提供了为治疗目的操纵免疫蛋白酶体组装的方法。β5i 过表达可以显着减弱这些影响。从机制上讲,α-Syn 抑制了核因子红细胞 2 相关因子 2 (NRF2) 对 POMP 的转录调节,从而阻止了免疫蛋白酶体 β 亚基的组装。NRF2-POMP 轴的多巴胺能神经元特异性过表达有效地挽救了 α-Syn 和 PD 样表型的聚集。这些发现将异常的免疫蛋白酶体组装描述为控制 α-Syn 积累和神经变性的关键因素,这可能为免疫蛋白酶体在 PD 中的意义开辟了新的视角,并提供了为治疗目的操纵免疫蛋白酶体组装的方法。从而阻止免疫蛋白酶体β亚基的组装。NRF2-POMP 轴的多巴胺能神经元特异性过表达有效地挽救了 α-Syn 和 PD 样表型的聚集。这些发现将异常的免疫蛋白酶体组装描述为控制 α-Syn 积累和神经变性的关键因素,这可能为免疫蛋白酶体在 PD 中的意义开辟了新的视角,并提供了为治疗目的操纵免疫蛋白酶体组装的方法。从而阻止免疫蛋白酶体β亚基的组装。NRF2-POMP 轴的多巴胺能神经元特异性过表达有效地挽救了 α-Syn 和 PD 样表型的聚集。这些发现将异常的免疫蛋白酶体组装描述为控制 α-Syn 积累和神经变性的关键因素,这可能为免疫蛋白酶体在 PD 中的意义开辟了新的视角,并提供了为治疗目的操纵免疫蛋白酶体组装的方法。











































 京公网安备 11010802027423号
京公网安备 11010802027423号