当前位置:
X-MOL 学术
›
Aging Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
microRNA-425 loss mediates amyloid plaque microenvironment heterogeneity and promotes neurodegenerative pathologies
Aging Cell ( IF 8.0 ) Pub Date : 2021-09-12 , DOI: 10.1111/acel.13454 Yong-Bo Hu 1, 2, 3 , Yong-Fang Zhang 2 , Ru-Jing Ren 1 , Eric B Dammer 4 , Xin-Yi Xie 1 , Shi-Wu Chen 1 , Qiang Huang 1 , Wan-Ying Huang 2 , Rui Zhang 2 , Hong-Zhuan Chen 5 , Hao Wang 2 , Gang Wang 1
Aging Cell ( IF 8.0 ) Pub Date : 2021-09-12 , DOI: 10.1111/acel.13454 Yong-Bo Hu 1, 2, 3 , Yong-Fang Zhang 2 , Ru-Jing Ren 1 , Eric B Dammer 4 , Xin-Yi Xie 1 , Shi-Wu Chen 1 , Qiang Huang 1 , Wan-Ying Huang 2 , Rui Zhang 2 , Hong-Zhuan Chen 5 , Hao Wang 2 , Gang Wang 1
Affiliation
|
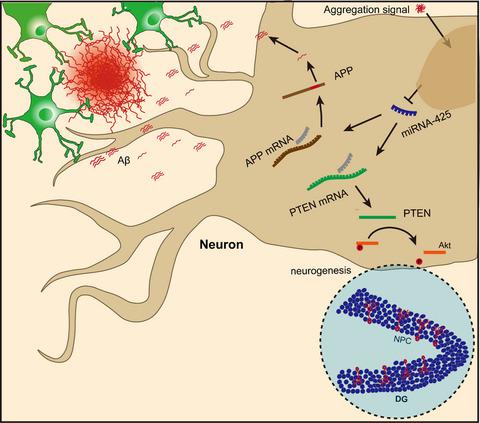
Different cellular and molecular changes underlie the pathogenesis of Alzheimer's disease (AD). Among these, neuron-specific dysregulation is a necessary event for accumulation of classic pathologies including amyloid plaques. Here, we show that AD-associated pathophysiology including neuronal cell death, inflammatory signaling, and endolysosomal dysfunction is spatially colocalized to amyloid plaques in regions with abnormal microRNA-425 (miR-425) levels and this change leads to focal brain microenvironment heterogeneity, that is, an amyloid plaque-associated microenvironment (APAM). APAM consists of multiple specific neurodegenerative signature pathologies associated with senile plaques that contribute to the heterogeneity and complexity of AD. Remarkably, miR-425, a neuronal-specific regulator decreased in AD brain, maintains a normal spatial transcriptome within brain neurons. We tested the hypothesis that miR-425 loss correlates with enhanced levels of mRNA targets downstream, supporting APAM and AD progression. A miR-425-deficient mouse model has enhanced APP amyloidogenic processing, neuroinflammation, neuron loss, and cognitive impairment. In the APP/PS1 mouse model, intervening with miR-425 supplementation ameliorated APAM changes and memory deficits. This study reveals a novel mechanism of dysregulation of spatial transcriptomic changes in AD brain, identifying a probable neuronal-specific microRNA regulator capable of staving off amyloid pathogenesis. Moreover, our findings provide new insights for developing AD treatment strategies with miRNA oligonucleotide(s).
中文翻译:

microRNA-425 丢失介导淀粉样斑块微环境异质性并促进神经退行性疾病
不同的细胞和分子变化是阿尔茨海默病 (AD) 发病机制的基础。其中,神经元特异性失调是包括淀粉样斑块在内的经典病理积累的必要事件。在这里,我们表明 AD 相关的病理生理学包括神经元细胞死亡、炎症信号传导和内溶酶体功能障碍在空间上共定位于具有异常 microRNA-425 (miR-425) 水平的区域的淀粉样蛋白斑块,这种变化导致局灶性脑微环境异质性,即是,淀粉样斑块相关微环境(APAM)。APAM 由多种与老年斑相关的特定神经退行性特征病理组成,这些病理导致 AD 的异质性和复杂性。值得注意的是,神经元特异性调节剂 miR-425 在 AD 脑中降低,在脑神经元内维持正常的空间转录组。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。确定一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。确定一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。
更新日期:2021-10-17
中文翻译:

microRNA-425 丢失介导淀粉样斑块微环境异质性并促进神经退行性疾病
不同的细胞和分子变化是阿尔茨海默病 (AD) 发病机制的基础。其中,神经元特异性失调是包括淀粉样斑块在内的经典病理积累的必要事件。在这里,我们表明 AD 相关的病理生理学包括神经元细胞死亡、炎症信号传导和内溶酶体功能障碍在空间上共定位于具有异常 microRNA-425 (miR-425) 水平的区域的淀粉样蛋白斑块,这种变化导致局灶性脑微环境异质性,即是,淀粉样斑块相关微环境(APAM)。APAM 由多种与老年斑相关的特定神经退行性特征病理组成,这些病理导致 AD 的异质性和复杂性。值得注意的是,神经元特异性调节剂 miR-425 在 AD 脑中降低,在脑神经元内维持正常的空间转录组。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。我们检验了 miR-425 缺失与下游 mRNA 靶标水平升高相关的假设,从而支持 APAM 和 AD 进展。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。miR-425 缺陷小鼠模型增强了 APP 淀粉样蛋白生成处理、神经炎症、神经元丢失和认知障碍。在 APP/PS1 小鼠模型中,干预 miR-425 补充剂可改善 APAM 变化和记忆缺陷。这项研究揭示了 AD 大脑空间转录组变化失调的新机制,确定了一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。确定一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。确定一种可能的神经元特异性 microRNA 调节剂,能够阻止淀粉样蛋白的发病。此外,我们的研究结果为使用 miRNA 寡核苷酸开发 AD 治疗策略提供了新的见解。











































 京公网安备 11010802027423号
京公网安备 11010802027423号