当前位置:
X-MOL 学术
›
Biol. Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Role of regulatory C-terminal motifs in synaptic confinement of LRRTM2
Biology of the Cell ( IF 2.4 ) Pub Date : 2021-09-09 , DOI: 10.1111/boc.202100026 Konstantina Liouta 1, 2 , Julia Chabbert 1, 2 , Sebastien Benquet 1, 2 , Béatrice Tessier 1, 2 , Vincent Studer 1, 2 , Matthieu Sainlos 1, 2 , Joris De Wit 3, 4 , Olivier Thoumine 1, 2 , Ingrid Chamma 1, 2
Biology of the Cell ( IF 2.4 ) Pub Date : 2021-09-09 , DOI: 10.1111/boc.202100026 Konstantina Liouta 1, 2 , Julia Chabbert 1, 2 , Sebastien Benquet 1, 2 , Béatrice Tessier 1, 2 , Vincent Studer 1, 2 , Matthieu Sainlos 1, 2 , Joris De Wit 3, 4 , Olivier Thoumine 1, 2 , Ingrid Chamma 1, 2
Affiliation
|
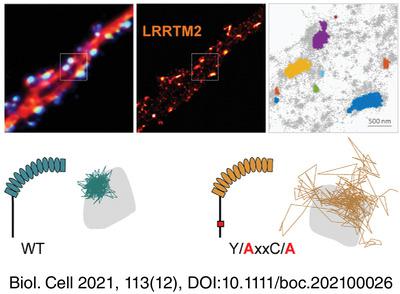
Leucine Rich Repeat Transmembrane proteins (LRRTMs) are neuronal cell adhesion molecules involved in synapse development and plasticity. LRRTM2 is the most synaptogenic isoform of the family, and its expression is strongly restricted to excitatory synapses in mature neurons. However, the mechanisms by which LRRTM2 is trafficked and stabilized at synapses remain unknown. Here, we examine the role of LRRTM2 intracellular domain on its membrane expression and stabilization at excitatory synapses, using a knock-down strategy combined to single molecule tracking and super-resolution dSTORM microscopy. We show that LRRTM2 operates an important shift in mobility after synaptogenesis in hippocampal neurons. Knock-down of LRRTM2 during synapse formation reduced excitatory synapse density in mature neurons. Deletion of LRRTM2 C-terminal domain abolished the compartmentalization of LRRTM2 in dendrites and disrupted its synaptic enrichment. Furtheremore, we show that LRRTM2 diffusion is increased in the absence of its intracellular domain, and that the protein is more dispersed at synapses. Surprisingly, LRRTM2 confinement at synapses was strongly dependent on a YxxC motif in the C-terminal domain, but was independent of the PDZ-like binding motif ECEV. Finally, the nanoscale organization of LRRTM2 at excitatory synapses depended on its C-terminal domain, with involvement of both the PDZ-binding and YxxC motifs. Altogether, these results demonstrate that LRRTM2 trafficking and enrichment at excitatory synapses are dependent on its intracellular domain.
中文翻译:

调节性 C 末端基序在 LRRTM2 突触限制中的作用
富含亮氨酸的重复跨膜蛋白 (LRRTM) 是参与突触发育和可塑性的神经元细胞粘附分子。LRRTM2 是该家族中最具突触性的同种型,其表达强烈限于成熟神经元中的兴奋性突触。然而,LRRTM2 在突触处被贩运和稳定的机制仍然未知。在这里,我们使用结合单分子跟踪和超分辨率 dSTORM 显微镜的击倒策略来检查 LRRTM2 细胞内结构域对其膜表达和兴奋性突触稳定的作用。我们表明,LRRTM2 在海马神经元突触发生后的移动性发生了重要转变。在突触形成过程中敲除 LRRTM2 会降低成熟神经元中的兴奋性突触密度。LRRTM2 C 末端结构域的删除消除了 LRRTM2 在树突中的区室化并破坏了其突触富集。此外,我们表明 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。我们发现 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。我们发现 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。但与 PDZ 样结合基序 ECEV 无关。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。但与 PDZ 样结合基序 ECEV 无关。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。
更新日期:2021-09-09
中文翻译:

调节性 C 末端基序在 LRRTM2 突触限制中的作用
富含亮氨酸的重复跨膜蛋白 (LRRTM) 是参与突触发育和可塑性的神经元细胞粘附分子。LRRTM2 是该家族中最具突触性的同种型,其表达强烈限于成熟神经元中的兴奋性突触。然而,LRRTM2 在突触处被贩运和稳定的机制仍然未知。在这里,我们使用结合单分子跟踪和超分辨率 dSTORM 显微镜的击倒策略来检查 LRRTM2 细胞内结构域对其膜表达和兴奋性突触稳定的作用。我们表明,LRRTM2 在海马神经元突触发生后的移动性发生了重要转变。在突触形成过程中敲除 LRRTM2 会降低成熟神经元中的兴奋性突触密度。LRRTM2 C 末端结构域的删除消除了 LRRTM2 在树突中的区室化并破坏了其突触富集。此外,我们表明 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。我们发现 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。我们发现 LRRTM2 扩散在没有其细胞内结构域的情况下增加,并且蛋白质在突触处更分散。令人惊讶的是,突触处的 LRRTM2 限制强烈依赖于 C 端域中的 YxxC 基序,但独立于 PDZ 样结合基序 ECEV。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。但与 PDZ 样结合基序 ECEV 无关。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。但与 PDZ 样结合基序 ECEV 无关。最后,LRRTM2 在兴奋性突触处的纳米级组织取决于其 C 端结构域,同时涉及 PDZ 结合和 YxxC 基序。总之,这些结果表明 LRRTM2 在兴奋性突触处的运输和富集依赖于其细胞内结构域。











































 京公网安备 11010802027423号
京公网安备 11010802027423号