当前位置:
X-MOL 学术
›
Chem. Rev.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Protein–Small Molecule Interactions in Native Mass Spectrometry
Chemical Reviews ( IF 62.1 ) Pub Date : 2021-08-27 , DOI: 10.1021/acs.chemrev.1c00293 Jack L Bennett 1 , Giang T H Nguyen 1 , William A Donald 1
Chemical Reviews ( IF 62.1 ) Pub Date : 2021-08-27 , DOI: 10.1021/acs.chemrev.1c00293 Jack L Bennett 1 , Giang T H Nguyen 1 , William A Donald 1
Affiliation
|
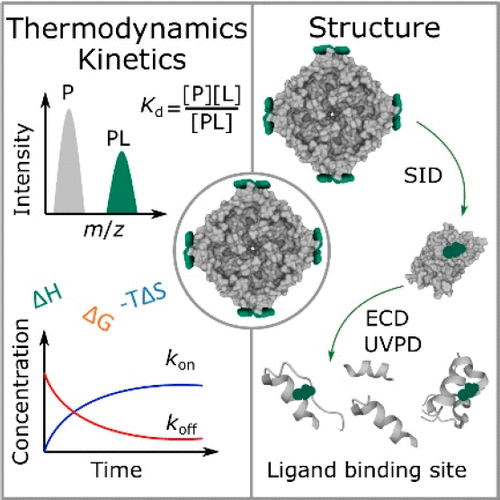
Small molecule drug discovery has been propelled by the continual development of novel scientific methodologies to occasion therapeutic advances. Although established biophysical methods can be used to obtain information regarding the molecular mechanisms underlying drug action, these approaches are often inefficient, low throughput, and ineffective in the analysis of heterogeneous systems including dynamic oligomeric assemblies and proteins that have undergone extensive post-translational modification. Native mass spectrometry can be used to probe protein–small molecule interactions with unprecedented speed and sensitivity, providing unique insights into polydisperse biomolecular systems that are commonly encountered during the drug discovery process. In this review, we describe potential and proven applications of native MS in the study of interactions between small, drug-like molecules and proteins, including large multiprotein complexes and membrane proteins. Approaches to quantify the thermodynamic and kinetic properties of ligand binding are discussed, alongside a summary of gas-phase ion activation techniques that have been used to interrogate the structure of protein–small molecule complexes. We additionally highlight some of the key areas in modern drug design for which native mass spectrometry has elicited significant advances. Future developments and applications of native mass spectrometry in drug discovery workflows are identified, including potential pathways toward studying protein–small molecule interactions on a whole-proteome scale.
中文翻译:

天然质谱中的蛋白质-小分子相互作用
新的科学方法的不断发展推动了小分子药物的发现,以促进治疗的进步。虽然已建立的生物物理方法可用于获取有关药物作用分子机制的信息,但这些方法在分析异质系统(包括动态寡聚组装体和经过广泛翻译后修饰的蛋白质)时通常效率低下、通量低且无效。原生质谱法可用于以前所未有的速度和灵敏度探测蛋白质-小分子相互作用,为药物发现过程中常见的多分散生物分子系统提供独特的见解。在本次审查中,我们描述了天然 MS 在研究小型药物样分子和蛋白质(包括大型多蛋白复合物和膜蛋白)之间相互作用的潜在和经过验证的应用。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。包括大的多蛋白复合物和膜蛋白。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。包括大的多蛋白复合物和膜蛋白。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。以及已用于询问蛋白质-小分子复合物结构的气相离子活化技术的总结。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。以及已用于询问蛋白质-小分子复合物结构的气相离子活化技术的总结。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。
更新日期:2021-08-27
中文翻译:

天然质谱中的蛋白质-小分子相互作用
新的科学方法的不断发展推动了小分子药物的发现,以促进治疗的进步。虽然已建立的生物物理方法可用于获取有关药物作用分子机制的信息,但这些方法在分析异质系统(包括动态寡聚组装体和经过广泛翻译后修饰的蛋白质)时通常效率低下、通量低且无效。原生质谱法可用于以前所未有的速度和灵敏度探测蛋白质-小分子相互作用,为药物发现过程中常见的多分散生物分子系统提供独特的见解。在本次审查中,我们描述了天然 MS 在研究小型药物样分子和蛋白质(包括大型多蛋白复合物和膜蛋白)之间相互作用的潜在和经过验证的应用。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。包括大的多蛋白复合物和膜蛋白。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。包括大的多蛋白复合物和膜蛋白。讨论了量化配体结合的热力学和动力学特性的方法,同时总结了已用于询问蛋白质-小分子复合物结构的气相离子活化技术。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。以及已用于询问蛋白质-小分子复合物结构的气相离子活化技术的总结。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。以及已用于询问蛋白质-小分子复合物结构的气相离子活化技术的总结。我们还强调了现代药物设计中的一些关键领域,在这些领域中,原生质谱已经引发了重大进展。确定了天然质谱在药物发现工作流程中的未来发展和应用,包括在全蛋白质组规模上研究蛋白质-小分子相互作用的潜在途径。



























 京公网安备 11010802027423号
京公网安备 11010802027423号