当前位置:
X-MOL 学术
›
Immunology
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Activated invariant natural killer T cells infiltrate aortic tissue as key participants in abdominal aortic aneurysm pathology
Immunology ( IF 4.9 ) Pub Date : 2021-08-11 , DOI: 10.1111/imm.13401 Tianyu Miao 1 , Tiehao Wang 1 , Ting Feng 2 , Ding Yuan 1 , Qiang Guo 1 , Fei Xiong 1 , Yi Yang 1 , Lihua Liu 3 , Zhangyu He 3 , Bin Huang 1 , Jichun Zhao 1
Immunology ( IF 4.9 ) Pub Date : 2021-08-11 , DOI: 10.1111/imm.13401 Tianyu Miao 1 , Tiehao Wang 1 , Ting Feng 2 , Ding Yuan 1 , Qiang Guo 1 , Fei Xiong 1 , Yi Yang 1 , Lihua Liu 3 , Zhangyu He 3 , Bin Huang 1 , Jichun Zhao 1
Affiliation
|
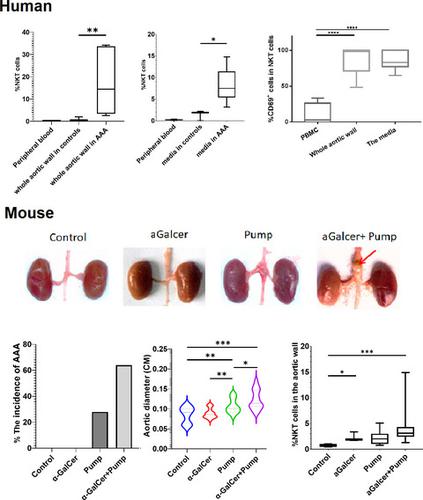
Adaptive immunity and innate immunity have been implicated in the pathogenesis of abdominal aortic aneurysm (AAA), and damage and remodelling in the tunica media are a focus of the aneurysm development. Thus, identification of key immune cells or molecules that might be targets for the treatment of AAA is critical. We characterized the innate immune cells in human AAA tissue specimens by flow cytometry and found that apart from other lymphocytes, many invariant natural killer T (iNKT) cells marked as CD3 and Va24Ja18 had invaded the aortic tissues and were numerous, especially in the tunica media. These infiltrating iNKT cells have a high expression of CD69, indicating a highly active function. We were interested in whether iNKT cells could be the drivers of media damage in AAA. To answer this question, we used an AAA mouse model induced by angiotensin II (Ang II) infusion, which can reproduce the inflammatory response of AAA in mouse, which was confirmed by RNAseq. The results showed that the incidence of AAA was significantly higher after administration of α-galactosylceramide (α-GalCer), a synthetic glycolipid that activates iNKT cells via CD1d, compared with the Ang II-induced AAA alone (61·54% vs 31·82%) in mice. Histopathological and immunofluorescent staining results showed significantly more severe inflammatory infiltration and pathological lesions in the Ang II+α-GalCer treatment group. These results are highly suggestive that activated iNKT cells greatly contribute to AAA development and that the control of the activation state in iNKT cells may represent an important therapeutic strategy for AAA.
中文翻译:

激活的不变自然杀伤 T 细胞浸润主动脉组织作为腹主动脉瘤病理学的关键参与者
适应性免疫和先天免疫与腹主动脉瘤 (AAA) 的发病机制有关,而中膜的损伤和重塑是动脉瘤发展的重点。因此,鉴定可能成为 AAA 治疗靶标的关键免疫细胞或分子至关重要。我们通过流式细胞术对人类 AAA 组织标本中的先天免疫细胞进行了表征,发现除了其他淋巴细胞外,许多标记为 CD3 和 Va24Ja18 的不变自然杀伤 T (iNKT) 细胞侵入了主动脉组织并且数量众多,尤其是在中膜中. 这些浸润性 iNKT 细胞具有高表达的 CD69,表明具有高度活跃的功能。我们感兴趣的是 iNKT 细胞是否是 AAA 中介质损伤的驱动因素。要回答这个问题,我们使用了血管紧张素 II (Ang II) 输注诱导的 AAA 小鼠模型,它可以在小鼠体内重现 AAA 的炎症反应,这已被 RNAseq 证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖苷神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。可重现小鼠AAA的炎症反应,经RNAseq证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。可重现小鼠AAA的炎症反应,经RNAseq证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖苷神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。与小鼠中单独由 Ang II 诱导的 AAA 相比(61·54% 对 31·82%)。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。与小鼠中单独由 Ang II 诱导的 AAA 相比(61·54% 对 31·82%)。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。
更新日期:2021-08-11
中文翻译:

激活的不变自然杀伤 T 细胞浸润主动脉组织作为腹主动脉瘤病理学的关键参与者
适应性免疫和先天免疫与腹主动脉瘤 (AAA) 的发病机制有关,而中膜的损伤和重塑是动脉瘤发展的重点。因此,鉴定可能成为 AAA 治疗靶标的关键免疫细胞或分子至关重要。我们通过流式细胞术对人类 AAA 组织标本中的先天免疫细胞进行了表征,发现除了其他淋巴细胞外,许多标记为 CD3 和 Va24Ja18 的不变自然杀伤 T (iNKT) 细胞侵入了主动脉组织并且数量众多,尤其是在中膜中. 这些浸润性 iNKT 细胞具有高表达的 CD69,表明具有高度活跃的功能。我们感兴趣的是 iNKT 细胞是否是 AAA 中介质损伤的驱动因素。要回答这个问题,我们使用了血管紧张素 II (Ang II) 输注诱导的 AAA 小鼠模型,它可以在小鼠体内重现 AAA 的炎症反应,这已被 RNAseq 证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖苷神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。可重现小鼠AAA的炎症反应,经RNAseq证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。可重现小鼠AAA的炎症反应,经RNAseq证实。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖苷神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。结果表明,与单独使用 Ang II 诱导的 AAA 相比,使用 α-半乳糖神经酰胺 (α-GalCer) 后 AAA 的发生率显着升高(61·54% vs 31· 82%) 在小鼠中。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。与小鼠中单独由 Ang II 诱导的 AAA 相比(61·54% 对 31·82%)。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。与小鼠中单独由 Ang II 诱导的 AAA 相比(61·54% 对 31·82%)。组织病理学和免疫荧光染色结果显示,Ang II+α-GalCer 治疗组的炎症浸润和病理损伤明显更严重。这些结果高度提示激活的 iNKT 细胞极大地促进了 AAA 的发展,并且控制 iNKT 细胞中的激活状态可能代表 AAA 的重要治疗策略。











































 京公网安备 11010802027423号
京公网安备 11010802027423号