Bioactive Materials ( IF 18.0 ) Pub Date : 2021-07-15 , DOI: 10.1016/j.bioactmat.2021.06.036 Daniel de Melo Pereira 1 , Noel Davison 1 , Pamela Habibović 1
|
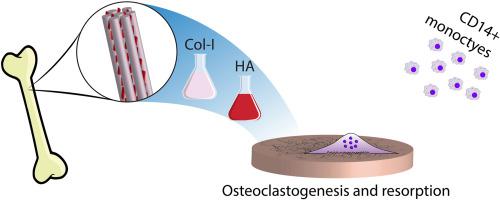
Biomineralized collagen composite materials pose an intriguing alternative to current synthetic bone graft substitutes by offering a biomimetic composition that closely resembles native bone. We hypothesize that this composite can undergo cellular resorption and remodeling similar to natural bone. We investigate the formation and activity of human osteoclasts cultured on biomineralized collagen and pure collagen membranes in comparison to cortical bone slices. Human monocytes/macrophages from peripheral blood differentiate into multinucleated, tartrate-resistant alkaline phosphatase (TRAP)-positive osteoclast-like cells on all substrates. These cells form clear actin rings on cortical bone, but not on biomineralized collagen or pure collagen membranes. Osteoclasts form resorption pits in cortical bone, resulting in higher calcium ion concentration in cell culture medium; however, osteoclast resorption of biomineralized collagen and collagen membranes does not measurably occur. Activity of osteoclast enzymes – TRAP, carbonic anhydrase II (CA-II), and cathepsin-K (CTS-K) – is similar on all substrates, despite phenotypic differences in actin ring formation and resorption. The mesh-like structure, relatively low stiffness, and lack of RGD-containing binding domains are likely the factors responsible for preventing formation of stable actin rings on and resorption of (biomineralized) collagen membranes. This insight helps to guide further research toward the optimized design of biomineralized collagen composites as a more biomimetic bone-graft substitute.
中文翻译:

人破骨细胞对生物矿化胶原蛋白的形成和吸收功能
生物矿化胶原复合材料通过提供与天然骨非常相似的仿生成分,成为当前合成骨移植替代品的有趣替代品。我们假设这种复合材料可以进行类似于天然骨骼的细胞吸收和重塑。我们研究了与皮质骨切片相比,在生物矿化胶原和纯胶原膜上培养的人类破骨细胞的形成和活性。来自外周血的人单核细胞/巨噬细胞在所有基质上分化为多核、抗酒石酸碱性磷酸酶 (TRAP) 阳性破骨细胞样细胞。这些细胞在皮质骨上形成清晰的肌动蛋白环,但不在生物矿化胶原或纯胶原膜上形成。破骨细胞在皮质骨中形成吸收坑,导致细胞培养基中钙离子浓度较高;然而,生物矿化胶原蛋白和胶原蛋白膜的破骨细胞吸收不会发生。尽管肌动蛋白环形成和吸收的表型存在差异,但破骨细胞酶(TRAP、碳酸酐酶 II (CA-II) 和组织蛋白酶-K (CTS-K))的活性在所有底物上都相似。网状结构、相对较低的刚度和缺乏包含 RGD 的结合域可能是导致稳定肌动蛋白环形成和(生物矿化)胶原膜吸收的原因。这一见解有助于指导进一步研究生物矿化胶原复合材料作为更具仿生性的骨移植替代品的优化设计。生物矿化胶原和胶原膜的破骨细胞吸收不会发生可测量的。尽管肌动蛋白环形成和吸收的表型存在差异,但破骨细胞酶(TRAP、碳酸酐酶 II (CA-II) 和组织蛋白酶-K (CTS-K))的活性在所有底物上都相似。网状结构、相对较低的刚度和缺乏包含 RGD 的结合域可能是导致稳定肌动蛋白环形成和(生物矿化)胶原膜吸收的原因。这一见解有助于指导进一步研究生物矿化胶原复合材料作为更具仿生性的骨移植替代品的优化设计。生物矿化胶原和胶原膜的破骨细胞吸收不会发生可测量的。尽管肌动蛋白环形成和吸收的表型存在差异,但破骨细胞酶(TRAP、碳酸酐酶 II (CA-II) 和组织蛋白酶-K (CTS-K))的活性在所有底物上都相似。网状结构、相对较低的刚度和缺乏包含 RGD 的结合域可能是导致稳定肌动蛋白环形成和(生物矿化)胶原膜吸收的原因。这一见解有助于指导进一步研究生物矿化胶原复合材料作为更具仿生性的骨移植替代品的优化设计。尽管肌动蛋白环的形成和吸收存在表型差异。网状结构、相对较低的刚度和缺乏包含 RGD 的结合域可能是导致稳定肌动蛋白环形成和(生物矿化)胶原膜吸收的原因。这一见解有助于指导进一步研究生物矿化胶原复合材料作为更具仿生性的骨移植替代品的优化设计。尽管肌动蛋白环的形成和吸收存在表型差异。网状结构、相对较低的刚度和缺乏包含 RGD 的结合域可能是导致稳定肌动蛋白环形成和(生物矿化)胶原膜吸收的原因。这一见解有助于指导进一步研究生物矿化胶原复合材料作为更具仿生性的骨移植替代品的优化设计。











































 京公网安备 11010802027423号
京公网安备 11010802027423号