Neuroscience ( IF 2.9 ) Pub Date : 2021-02-18 , DOI: 10.1016/j.neuroscience.2021.02.009 Akira Mizoguchi , Ryoichi Banno , Runan Sun , Hiroshi Yaginuma , Keigo Taki , Tomoko Kobayashi , Mariko Sugiyama , Taku Tsunekawa , Takeshi Onoue , Hiroshi Takagi , Daisuke Hagiwara , Yoshihiro Ito , Shintaro Iwama , Hidetaka Suga , Hiroshi Arima
|
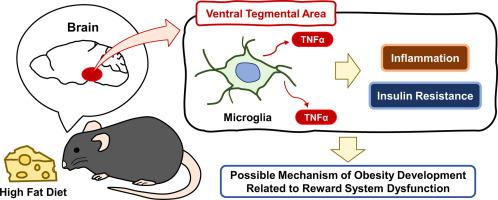
The reward system plays an important role in the pathogenesis of not only drug addiction, but also diet-induced obesity. Recent studies have shown that insulin and leptin receptor signaling in the ventral tegmental area (VTA) regulate energy homeostasis and that their dysregulation is responsible for obesity and altered food preferences. Although a high-fat diet (HFD) induces inflammation that leads to insulin and leptin resistance in the brain, it remains unclear whether HFD induces inflammation in the VTA. In the present study, we placed male mice on a chow diet or HFD for 3, 7, and 28 days and evaluated the mRNA expression of inflammatory cytokines and microglial activation markers in the VTA. The HFD group showed significantly elevated mRNA expressions of IL1β at 3 days; tumor necrosis factor-alpha (TNFα), IL1β, IL6, Iba1, and CD11b at 7 days; and TNFα, IL1β, Iba1, and CD11b at 28 days. The changes in TNFα were also confirmed in immunohistochemical analysis. Next, after administration of chow or HFD for 7 days, we selected mice with equal weights in both groups. In experiments using these mice, Akt phosphorylation in the VTA was significantly decreased after intracerebroventricular injection of insulin, whereas no change in STAT3 phosphorylation was found with leptin. Taken together, these results suggest that HFD induces inflammation at least partly associated with microglial activation in the VTA leading to insulin resistance, independently of the energy balance. Our data provide new insight into the pathophysiology of obesity caused by a dysfunctional reward system under HFD conditions.
中文翻译:

高脂喂养会引起小鼠腹侧被盖区的炎症和胰岛素抵抗
奖励系统不仅在药物成瘾的发病机理中,而且在饮食诱导的肥胖症的发病机理中都起着重要作用。最近的研究表明,腹侧被盖区(VTA)中的胰岛素和瘦素受体信号传导调节能量稳态,并且它们的失调是肥胖和食物偏好改变的原因。尽管高脂饮食(HFD)会诱发大脑中的胰岛素和瘦素抵抗性炎症,但目前尚不清楚HFD是否会诱发VTA炎症。在本研究中,我们将雄性小鼠饮食或HFD饮食3天,7天和28天,并评估了VTA中炎性细胞因子和小胶质细胞激活标志物的mRNA表达。HFD组在第3天时IL1β的mRNA表达显着升高。7天时出现肿瘤坏死因子-α(TNFα),IL1β,IL6,Iba1和CD11b;28天时的TNFα,IL1β,Iba1和CD11b。免疫组织化学分析也证实了TNFα的变化。接下来,在给予食物或HFD 7天后,我们在两组中选择了体重相等的小鼠。在使用这些小鼠的实验中,脑室内注射胰岛素后VTA中的Akt磷酸化显着降低,而瘦素未发现STAT3磷酸化的变化。综上所述,这些结果表明,HFD至少与能量平衡无关地诱发至少部分与VTA中小胶质细胞活化相关的炎症,从而导致胰岛素抵抗。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。免疫组织化学分析也证实了TNFα的变化。接下来,在给予食物或HFD 7天后,我们在两组中选择了体重相等的小鼠。在使用这些小鼠的实验中,脑室内注射胰岛素后VTA中的Akt磷酸化显着降低,而瘦素未发现STAT3磷酸化的变化。综上所述,这些结果表明,HFD至少与能量平衡无关地诱发至少部分与VTA中小胶质细胞活化相关的炎症,从而导致胰岛素抵抗。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。免疫组织化学分析也证实了TNFα的变化。接下来,在给予食物或HFD 7天后,我们在两组中选择了体重相等的小鼠。在使用这些小鼠的实验中,脑室内注射胰岛素后VTA中的Akt磷酸化显着降低,而瘦蛋白未发现STAT3磷酸化的变化。综上所述,这些结果表明,HFD至少与能量平衡无关地诱发至少部分与VTA中小胶质细胞活化相关的炎症,从而导致胰岛素抵抗。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。在使用这些小鼠的实验中,脑室内注射胰岛素后VTA中的Akt磷酸化显着降低,而瘦蛋白未发现STAT3磷酸化的变化。综上所述,这些结果表明,HFD至少与能量平衡无关地诱发至少部分与VTA中小胶质细胞活化相关的炎症,从而导致胰岛素抵抗。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。在使用这些小鼠的实验中,脑室内注射胰岛素后VTA中的Akt磷酸化显着降低,而瘦素未发现STAT3磷酸化的变化。综上所述,这些结果表明,HFD至少与能量平衡无关地诱发至少部分与VTA中小胶质细胞活化相关的炎症,从而导致胰岛素抵抗。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。这些结果表明,HFD引起的炎症至少部分与VTA中的小胶质细胞活化有关,从而导致胰岛素抵抗,而与能量平衡无关。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。这些结果表明,HFD引起的炎症至少部分与VTA中的小胶质细胞活化有关,从而导致胰岛素抵抗,而与能量平衡无关。我们的数据为在HFD条件下功能紊乱的奖赏系统引起的肥胖症的病理生理学提供了新的见解。











































 京公网安备 11010802027423号
京公网安备 11010802027423号