Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Microglial remodeling of actin network by Tau oligomers, via G protein‐coupled purinergic receptor, P2Y12R‐driven chemotaxis
Traffic ( IF 3.6 ) Pub Date : 2021-02-01 , DOI: 10.1111/tra.12784 Rashmi Das 1, 2 , Subashchandrabose Chinnathambi 1, 2
Traffic ( IF 3.6 ) Pub Date : 2021-02-01 , DOI: 10.1111/tra.12784 Rashmi Das 1, 2 , Subashchandrabose Chinnathambi 1, 2
Affiliation
|
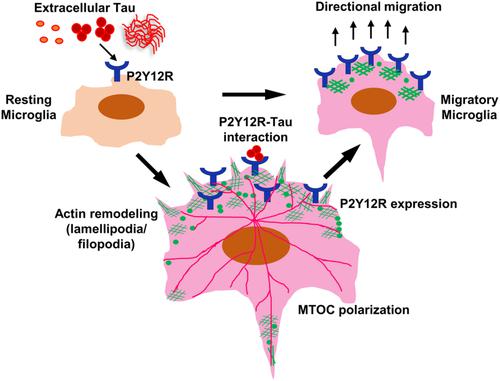
Alzheimer's disease (AD) is associated with age‐related neurodegeneration, synaptic deformation and chronic inflammation mediated by microglia and infiltrated macrophages in the brain. Tau oligomers can be released from damaged neurons via various mechanisms such as exosomes, neurotransmitter, membrane leakage etc. Microglia sense the extracellular Tau through several cell‐surface receptors and mediate chemotaxis and phagocytosis. The purinergic receptor P2Y12R recently gained interest in neurodegeneration for neuro‐glial communication and microglial chemotaxis towards the site of plaque deposition. To understand the effect of extracellular Tau oligomers in microglial migration, the P2Y12R‐mediated actin remodeling, reorientation of tubulin network and rate of migration were studied in the presence of ATP. The extracellular Tau species directly interacted with P2Y12R and also induced this purinoceptor expression in microglia. Microglial P2Y12R colocalized with remodeled membrane‐associated actin network as a component of migration in response to Tau oligomers. As an inducer of P2Y12R, ATP facilitated the localization of P2Y12R in lamellipodia and filopodia during accelerated microglial migration. The direct interaction of extracellular Tau oligomers with microglial P2Y12R would facilitate the signal transduction in both way, directional chemotaxis and receptor‐mediated phagocytosis. These unprecedented findings emphasize that microglia can modulate the membrane‐associated actin structure and incorporate P2Y12R to perceive the axis and rate of chemotaxis in Tauopathy.
中文翻译:

Tau 寡聚体通过 G 蛋白偶联嘌呤受体、P2Y12R 驱动的趋化性对肌动蛋白网络的小胶质细胞重塑
阿尔茨海默病 (AD) 与年龄相关的神经退行性变、突触变形和由脑中小胶质细胞和浸润的巨噬细胞介导的慢性炎症有关。Tau 寡聚体可以通过各种机制从受损神经元中释放出来,例如外泌体、神经递质、膜渗漏等。小胶质细胞通过几种细胞表面受体感知细胞外 Tau 并介导趋化性和吞噬作用。嘌呤能受体 P2Y12R 最近在神经变性中引起了人们的兴趣,用于神经胶质通讯和小胶质细胞对斑块沉积部位的趋化性。为了了解细胞外 Tau 寡聚体在小胶质细胞迁移中的作用,在 ATP 存在下研究了 P2Y12R 介导的肌动蛋白重塑、微管蛋白网络的重新定向和迁移速率。细胞外 Tau 物种直接与 P2Y12R 相互作用,并在小胶质细胞中诱导这种嘌呤受体表达。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。在加速的小胶质细胞迁移过程中,ATP 促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。在加速的小胶质细胞迁移过程中,ATP 促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。
更新日期:2021-04-02
中文翻译:

Tau 寡聚体通过 G 蛋白偶联嘌呤受体、P2Y12R 驱动的趋化性对肌动蛋白网络的小胶质细胞重塑
阿尔茨海默病 (AD) 与年龄相关的神经退行性变、突触变形和由脑中小胶质细胞和浸润的巨噬细胞介导的慢性炎症有关。Tau 寡聚体可以通过各种机制从受损神经元中释放出来,例如外泌体、神经递质、膜渗漏等。小胶质细胞通过几种细胞表面受体感知细胞外 Tau 并介导趋化性和吞噬作用。嘌呤能受体 P2Y12R 最近在神经变性中引起了人们的兴趣,用于神经胶质通讯和小胶质细胞对斑块沉积部位的趋化性。为了了解细胞外 Tau 寡聚体在小胶质细胞迁移中的作用,在 ATP 存在下研究了 P2Y12R 介导的肌动蛋白重塑、微管蛋白网络的重新定向和迁移速率。细胞外 Tau 物种直接与 P2Y12R 相互作用,并在小胶质细胞中诱导这种嘌呤受体表达。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。小胶质细胞 P2Y12R 与重构的膜相关肌动蛋白网络共定位,作为响应 Tau 寡聚体的迁移的一个组成部分。作为 P2Y12R 的诱导剂,ATP 在加速小胶质细胞迁移过程中促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。在加速的小胶质细胞迁移过程中,ATP 促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。在加速的小胶质细胞迁移过程中,ATP 促进了 P2Y12R 在片状伪足和丝状伪足中的定位。细胞外 Tau 寡聚体与小胶质细胞 P2Y12R 的直接相互作用将促进定向趋化和受体介导的吞噬作用的信号转导。这些前所未有的发现强调了小胶质细胞可以调节膜相关的肌动蛋白结构并结合 P2Y12R 来感知 Tauopathy 的轴和趋化率。











































 京公网安备 11010802027423号
京公网安备 11010802027423号