当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Modulation of Amyloidogenic Protein Self-Assembly Using Tethered Small Molecules
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-11-30 , DOI: 10.1021/jacs.0c10629 Emma E Cawood 1, 2, 3 , Nicolas Guthertz 1, 3 , Jessica S Ebo 1, 3 , Theodoros K Karamanos 1, 3, 4 , Sheena E Radford 1, 3 , Andrew J Wilson 1, 2
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-11-30 , DOI: 10.1021/jacs.0c10629 Emma E Cawood 1, 2, 3 , Nicolas Guthertz 1, 3 , Jessica S Ebo 1, 3 , Theodoros K Karamanos 1, 3, 4 , Sheena E Radford 1, 3 , Andrew J Wilson 1, 2
Affiliation
|
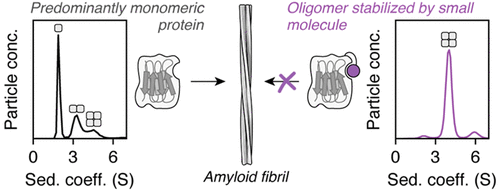
Protein–protein interactions (PPIs) are involved in many of life’s essential biological functions yet are also an underlying cause of several human diseases, including amyloidosis. The modulation of PPIs presents opportunities to gain mechanistic insights into amyloid assembly, particularly through the use of methods which can trap specific intermediates for detailed study. Such information can also provide a starting point for drug discovery. Here, we demonstrate that covalently tethered small molecule fragments can be used to stabilize specific oligomers during amyloid fibril formation, facilitating the structural characterization of these assembly intermediates. We exemplify the power of covalent tethering using the naturally occurring truncated variant (ΔN6) of the human protein β2-microglobulin (β2m), which assembles into amyloid fibrils associated with dialysis-related amyloidosis. Using this approach, we have trapped tetramers formed by ΔN6 under conditions which would normally lead to fibril formation and found that the degree of tetramer stabilization depends on the site of the covalent tether and the nature of the protein–fragment interaction. The covalent protein–ligand linkage enabled structural characterization of these trapped, off-pathway oligomers using X-ray crystallography and NMR, providing insight into why tetramer stabilization inhibits amyloid assembly. Our findings highlight the power of “post-translational chemical modification” as a tool to study biological molecular mechanisms.
中文翻译:

使用系留小分子调节淀粉样蛋白自组装
蛋白质-蛋白质相互作用 (PPI) 涉及生命的许多基本生物学功能,但也是导致多种人类疾病(包括淀粉样变性)的根本原因。PPI 的调制提供了获得淀粉样蛋白组装机械洞察的机会,特别是通过使用可以捕获特定中间体进行详细研究的方法。这些信息还可以为药物发现提供一个起点。在这里,我们证明共价连接的小分子片段可用于在淀粉样蛋白原纤维形成过程中稳定特定的低聚物,促进这些组装中间体的结构表征。我们使用人类蛋白质 β2-微球蛋白 (β2m) 的天然截短变体 (ΔN6) 来举例说明共价束缚的力量,它组装成与透析相关的淀粉样变性相关的淀粉样原纤维。使用这种方法,我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。使用 X 射线晶体学和 NMR 分析非通路寡聚物,深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。使用 X 射线晶体学和 NMR 分析非通路寡聚物,深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。
更新日期:2020-11-30
中文翻译:

使用系留小分子调节淀粉样蛋白自组装
蛋白质-蛋白质相互作用 (PPI) 涉及生命的许多基本生物学功能,但也是导致多种人类疾病(包括淀粉样变性)的根本原因。PPI 的调制提供了获得淀粉样蛋白组装机械洞察的机会,特别是通过使用可以捕获特定中间体进行详细研究的方法。这些信息还可以为药物发现提供一个起点。在这里,我们证明共价连接的小分子片段可用于在淀粉样蛋白原纤维形成过程中稳定特定的低聚物,促进这些组装中间体的结构表征。我们使用人类蛋白质 β2-微球蛋白 (β2m) 的天然截短变体 (ΔN6) 来举例说明共价束缚的力量,它组装成与透析相关的淀粉样变性相关的淀粉样原纤维。使用这种方法,我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。我们在通常会导致原纤维形成的条件下捕获了由 ΔN6 形成的四聚体,并发现四聚体的稳定程度取决于共价系链的位点和蛋白质 - 片段相互作用的性质。共价蛋白质 - 配体连接能够使用 X 射线晶体学和 NMR 对这些被捕获的非通路寡聚体进行结构表征,从而深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。使用 X 射线晶体学和 NMR 分析非通路寡聚物,深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。使用 X 射线晶体学和 NMR 分析非通路寡聚物,深入了解四聚体稳定化抑制淀粉样蛋白组装的原因。我们的研究结果突出了“翻译后化学修饰”作为研究生物分子机制的工具的力量。











































 京公网安备 11010802027423号
京公网安备 11010802027423号