当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Shifting Polar Residues Across Primary Sequence Frames of Transmembrane Domains Calibrates Membrane Permeation Thermodynamics
Biochemistry ( IF 2.9 ) Pub Date : 2020-11-02 , DOI: 10.1021/acs.biochem.0c00536 Souvik Sinha 1 , Shubhra Ghosh Dastidar 1
Biochemistry ( IF 2.9 ) Pub Date : 2020-11-02 , DOI: 10.1021/acs.biochem.0c00536 Souvik Sinha 1 , Shubhra Ghosh Dastidar 1
Affiliation
|
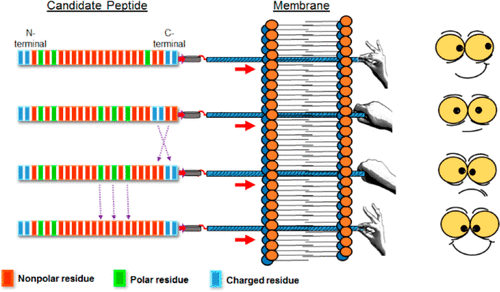
Permeation of the mitochondrial outer membrane (MOM) using the transmembrane domains (TMDs) is the key step of the Bcl-2 family of proteins to control apoptosis. The primary sequences of the TMDs of the family members like Bcl-xL, Bcl-2, Bak, etc. indicate the presence of charged residues at the C-terminal tip to be essential for drilling the membrane. However, Bax, a variant of the same family, is an exception, as the charged residues are shifted away from the tip by two positional frames in the primary sequence, but does it matter really? The free energy landscapes of membrane permeation, computed from a total of ∼13.3 μs of conformational sampling, show how such shifting of the amino acid frames in the primary sequence is correlated with the energy landscape that ensures the balance between membrane permeation and cytosolic population. Shifting the charged residues back to the terminal, in suitable mutants of Bax, proves the necessity of terminal charged residues by improving the insertion free energy but adds a high energy barrier unless some other polar residues are adjusted further. The difference in the TMDs of Bcl-xL and Bax is also reflected in their mechanism to drill the MOM-like anionic membrane; only Bax-TMD requires surface crowding to favorably shape the permeation landscape by weakening the bilayer integrity. So, this investigation suggests that such proteins can calibrate the free energy landscape of membrane permeation by adjusting the positions of the charged or polar residues in the primary sequence frames, a strategy analogous to the game of the “sliding tile puzzle” but played with primary sequence frames.
中文翻译:

跨跨膜结构域的主序列框架移动极性残基校准膜渗透热力学。
使用跨膜结构域(TMD)渗透线粒体外膜(MOM)是Bcl-2蛋白家族控制细胞凋亡的关键步骤。Bcl-xL,Bcl-2,Bak等家族成员TMD的主要序列表明,在C末端尖端存在带电荷的残基,这对于钻膜必不可少。但是,Bax是同一个家族的变体,是一个例外,因为带电的残基在主要序列中从尖端移开了两个位置框架,但这真的重要吗?由总共约13.3μs的构象采样计算得出的膜渗透的自由能态势表明,一级序列中氨基酸框架的这种位移如何与确保膜渗透率和胞质群体之间平衡的能势态相关联。在合适的Bax突变体中,将带电残基移回末端,通过改善插入自由能证明了带电末端残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。在合适的Bax突变体中,通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。在合适的Bax突变体中,通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMD的差异也反映在它们钻出类似MOM的阴离子膜的机理上。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。
更新日期:2020-11-17
中文翻译:

跨跨膜结构域的主序列框架移动极性残基校准膜渗透热力学。
使用跨膜结构域(TMD)渗透线粒体外膜(MOM)是Bcl-2蛋白家族控制细胞凋亡的关键步骤。Bcl-xL,Bcl-2,Bak等家族成员TMD的主要序列表明,在C末端尖端存在带电荷的残基,这对于钻膜必不可少。但是,Bax是同一个家族的变体,是一个例外,因为带电的残基在主要序列中从尖端移开了两个位置框架,但这真的重要吗?由总共约13.3μs的构象采样计算得出的膜渗透的自由能态势表明,一级序列中氨基酸框架的这种位移如何与确保膜渗透率和胞质群体之间平衡的能势态相关联。在合适的Bax突变体中,将带电残基移回末端,通过改善插入自由能证明了带电末端残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。在合适的Bax突变体中,通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。在合适的Bax突变体中,通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMD的差异也反映在它们钻出类似MOM的阴离子膜的机理上。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。通过改善插入自由能证明了末端带电残基的必要性,但是增加了高能垒,除非进一步调整一些其他极性残基。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。Bcl-xL和Bax的TMDs的差异也反映在它们对MOM状阴离子膜进行钻孔的机制中。只有Bax-TMD要求表面拥挤以通过削弱双层完整性来有利地塑造渗透景观。因此,这项研究表明,这类蛋白质可以通过调节一级序列框架中带电或极性残基的位置来校准膜渗透的自由能态,该策略类似于“滑动瓷砖拼图”的游戏,但主要用于一级序列帧。











































 京公网安备 11010802027423号
京公网安备 11010802027423号