当前位置:
X-MOL 学术
›
J. Neurochem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Revisiting the proteolytic processing of cell adhesion molecule L1
Journal of Neurochemistry ( IF 4.2 ) Pub Date : 2020-09-28 , DOI: 10.1111/jnc.15201 Ralf Kleene 1 , David Lutz 2, 3 , Gabriele Loers 1 , Ute Bork 1 , Uwe Borgmeyer 4 , Irm Hermans-Borgmeyer 4 , Melitta Schachner 5
Journal of Neurochemistry ( IF 4.2 ) Pub Date : 2020-09-28 , DOI: 10.1111/jnc.15201 Ralf Kleene 1 , David Lutz 2, 3 , Gabriele Loers 1 , Ute Bork 1 , Uwe Borgmeyer 4 , Irm Hermans-Borgmeyer 4 , Melitta Schachner 5
Affiliation
|
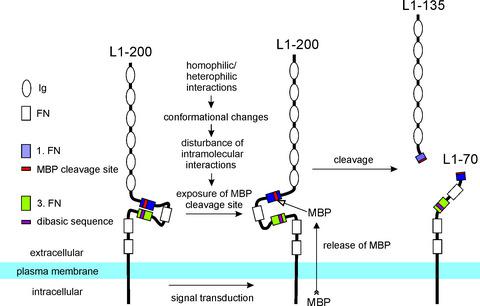
The important functions of cell adhesion molecule L1 in the nervous system depend on diverse proteolytic enzymes which generate different L1 fragments. It has been reported that cleavage in the third fibronectin type III (FNIII) homologous domain generates the fragments L1-80 and L1-140, while cleavage in the first FNIII domain yields the fragments L1-70 and L1-135. These results raised questions concerning the L1 cleavage sites. We thus generated gene-edited mice expressing L1 with mutations of the cleavage sites either in the first or third FNIII domain. By immunoprecipitations and immunoblot analyses using brain homogenates and different L1 antibodies, we show that L1-70 and L1-135 are generated in wild-type mice, but not or only to a low extent in L1 mutant mice. L1-80 and L1-140 were not detected in wild-type or mutant mice. Mass spectrometry confirmed the results from immunoprecipitations and immunoblot analyses. Based on these observations, we propose that L1-70 and L1-135 are the predominant fragments in the mouse nervous system and that the third FNIII domain is decisive for generating these fragments. Treatment of cultured cerebellar neurons with trypsin or plasmin, which were both proposed to generate L1-80 and L1-140 by cleaving in the third FNIII domain, showed by immunoprecipitations and immunoblot analyses that both proteases lead to the generation of L1-70 and L1-135, but not L1-80 and L1-140. We discuss previous observations on the basis of our new results and propose a novel view on the molecular features that render previous and present observations compatible.
中文翻译:

重温细胞粘附分子L1的蛋白水解过程
细胞粘附分子L1在神经系统中的重要功能取决于产生不同L1片段的各种蛋白水解酶。据报道,在第三个III型纤连蛋白(FNIII)同源结构域中的切割产生片段L1-80和L1-140,而在第一个FNIII结构域中的切割产生片段L1-70和L1-135。这些结果引起了关于L1切割位点的疑问。因此,我们生成了基因编辑的小鼠,该小鼠表达的L1在第一个或第三个FNIII域中均具有切割位点的突变。通过使用脑匀浆和不同的L1抗体的免疫沉淀和免疫印迹分析,我们显示L1-70和L1-135在野生型小鼠中产生,但在L1突变型小鼠中不产生或仅产生很小的程度。在野生型或突变型小鼠中未检测到L1-80和L1-140。质谱证实了免疫沉淀和免疫印迹分析的结果。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。
更新日期:2020-09-28
中文翻译:

重温细胞粘附分子L1的蛋白水解过程
细胞粘附分子L1在神经系统中的重要功能取决于产生不同L1片段的各种蛋白水解酶。据报道,在第三个III型纤连蛋白(FNIII)同源结构域中的切割产生片段L1-80和L1-140,而在第一个FNIII结构域中的切割产生片段L1-70和L1-135。这些结果引起了关于L1切割位点的疑问。因此,我们生成了基因编辑的小鼠,该小鼠表达的L1在第一个或第三个FNIII域中均具有切割位点的突变。通过使用脑匀浆和不同的L1抗体的免疫沉淀和免疫印迹分析,我们显示L1-70和L1-135在野生型小鼠中产生,但在L1突变型小鼠中不产生或仅产生很小的程度。在野生型或突变型小鼠中未检测到L1-80和L1-140。质谱证实了免疫沉淀和免疫印迹分析的结果。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。基于这些观察,我们提出L1-70和L1-135是小鼠神经系统中的主要片段,而第三个FNIII结构域对于产生这些片段起决定性作用。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。免疫沉淀和免疫印迹分析表明,用胰蛋白酶或纤溶酶处理培养的小脑神经元均通过裂解第三个FNIII结构域产生L1-80和L1-140,这两种蛋白酶均可导致L1-70和L1的产生。 -135,但不包括L1-80和L1-140。我们将根据新结果讨论先前的观察结果,并就使先前和目前的观察结果兼容的分子特征提出一种新颖的观点。











































 京公网安备 11010802027423号
京公网安备 11010802027423号