当前位置:
X-MOL 学术
›
Eur. J. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Cocaine self‐administration abolishes endocannabinoid‐mediated long‐term depression of glutamatergic synapses in the ventral tegmental area
European Journal of Neuroscience ( IF 2.7 ) Pub Date : 2020-09-21 , DOI: 10.1111/ejn.14980 Ruixiang Wang 1 , Kathryn A. Hausknecht 1 , Amy M. Gancarz‐Kausch 1, 2 , Saida Oubraim 1 , Roh‐Yu Shen 1 , Samir Haj‐Dahmane 1
European Journal of Neuroscience ( IF 2.7 ) Pub Date : 2020-09-21 , DOI: 10.1111/ejn.14980 Ruixiang Wang 1 , Kathryn A. Hausknecht 1 , Amy M. Gancarz‐Kausch 1, 2 , Saida Oubraim 1 , Roh‐Yu Shen 1 , Samir Haj‐Dahmane 1
Affiliation
|
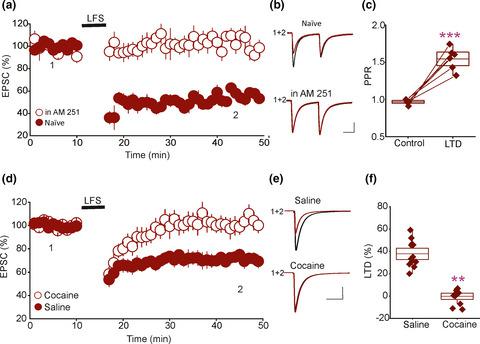
Drugs of abuse, including cocaine, alter the mechanisms underpinning synaptic plasticity, including long‐term potentiation of glutamatergic synapses in the mesolimbic system. These effects are thought to underlie addictive behaviors. In the ventral tegmental area (VTA), glutamatergic synapses also exhibit long‐term depression (LTD), a type of plasticity that weakens synaptic strength. This form of synaptic plasticity is induced by low‐frequency stimulation and mediated by endocannabinoid (eCB) signaling, which also modulates addictive behaviors. However, it remains unknown whether eCB‐LTD in the VTA could be altered by cocaine use. Therefore, the goal of the present study was to examine the impact of cocaine self‐administration on eCB‐LTD of glutamatergic synapses onto VTA dopaminergic (DA) neurons. To that end, male rats underwent cocaine (0.75 mg/kg/infusion) or saline self‐administration under the fixed ratio 1 schedule for 6–9 days. One day after the last self‐administration session, the magnitude of eCB‐LTD was examined using ex vivo whole‐cell recordings of putative VTA DA neurons from naïve rats and rats with saline or cocaine self‐administration. The results revealed that cocaine self‐administration abolished eCB‐LTD. The cocaine‐induced blockade of eCB‐LTD in the VTA was mediated by an impaired function of presynaptic CB1 receptors. Collectively, these findings indicate that cocaine exposure blunts eCB‐mediated synaptic plasticity in midbrain DA neurons. This effect could be one of the cellular mechanisms that mediate, at least in part, addictive behaviors.
中文翻译:

可卡因自我给药消除了腹侧被盖区谷氨酸能突触的内源性大麻素介导的长期抑制
包括可卡因在内的滥用药物会改变支撑突触可塑性的机制,包括中脑边缘系统中谷氨酸能突触的长期增强。这些作用被认为是成瘾行为的基础。在腹侧被盖区(VTA),谷氨酸能突触也表现出长期抑郁(LTD),这是一种可塑性,会削弱突触强度。这种形式的突触可塑性是由低频刺激诱导的,并由内源性大麻素(eCB)信号传导介导,后者还调节成瘾行为。但是,尚不清楚是否可以通过使用可卡因来改变VTA中的eCB‐LTD。因此,本研究的目的是研究可卡因自我给药对VTA多巴胺能(DA)神经元上谷氨酸能突触的eCB‐LTD的影响。为此,雄性大鼠接受可卡因(0。75 mg / kg /输注)或生理盐水按照固定比例1的时间表进行6到9天的自我管理。在最后一次自我给药后的第二天,使用离体大鼠和纯碱或可卡因自给药大鼠的假定的VTA DA神经元的离体全细胞记录,检查了eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。在最后一次自我给药后的第二天,使用离体大鼠和纯碱或可卡因自给药大鼠的假定的VTA DA神经元的离体全细胞记录,检查了eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。在最后一次自我给药后的第二天,使用离体全大鼠和纯大鼠或生理盐水或可卡因自给药的假定的VTA DA神经元的离体全细胞记录来检查eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。
更新日期:2020-10-02
中文翻译:

可卡因自我给药消除了腹侧被盖区谷氨酸能突触的内源性大麻素介导的长期抑制
包括可卡因在内的滥用药物会改变支撑突触可塑性的机制,包括中脑边缘系统中谷氨酸能突触的长期增强。这些作用被认为是成瘾行为的基础。在腹侧被盖区(VTA),谷氨酸能突触也表现出长期抑郁(LTD),这是一种可塑性,会削弱突触强度。这种形式的突触可塑性是由低频刺激诱导的,并由内源性大麻素(eCB)信号传导介导,后者还调节成瘾行为。但是,尚不清楚是否可以通过使用可卡因来改变VTA中的eCB‐LTD。因此,本研究的目的是研究可卡因自我给药对VTA多巴胺能(DA)神经元上谷氨酸能突触的eCB‐LTD的影响。为此,雄性大鼠接受可卡因(0。75 mg / kg /输注)或生理盐水按照固定比例1的时间表进行6到9天的自我管理。在最后一次自我给药后的第二天,使用离体大鼠和纯碱或可卡因自给药大鼠的假定的VTA DA神经元的离体全细胞记录,检查了eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。在最后一次自我给药后的第二天,使用离体大鼠和纯碱或可卡因自给药大鼠的假定的VTA DA神经元的离体全细胞记录,检查了eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。在最后一次自我给药后的第二天,使用离体全大鼠和纯大鼠或生理盐水或可卡因自给药的假定的VTA DA神经元的离体全细胞记录来检查eCB‐LTD的大小。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。结果表明,可卡因自我管理废除了eCB‐LTD。可卡因诱导的VTA中eCB‐LTD的阻断作用是由突触前CB1受体功能受损引起的。总的来说,这些发现表明可卡因暴露在中脑DA神经元中使eCB介导的突触可塑性变钝。这种作用可能是至少部分介导成瘾行为的细胞机制之一。











































 京公网安备 11010802027423号
京公网安备 11010802027423号