Journal of Structural Biology ( IF 3.0 ) Pub Date : 2020-09-21 , DOI: 10.1016/j.jsb.2020.107628 Deborah Harrus 1 , Anne Harduin-Lepers 2 , Tuomo Glumoff 1
|
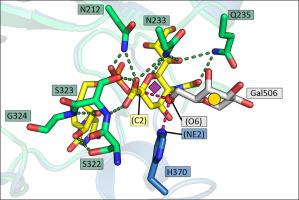
Sialic acid residues found as terminal monosaccharides in various types of glycan chains in cell surface glycoproteins and glycolipids have been identified as important contributors of cell-cell interactions in normal vs. abnormal cellular behavior and are pivotal in diseases such as cancers. In vertebrates, sialic acids are attached to glycan chains by a conserved subset of sialyltransferases with different enzymatic and substrate specificities. ST6Gal I is a sialyltransferase using activated CMP-sialic acids as donor substrates to catalyze the formation of a α2,6-glycosidic bond between the sialic acid residue and the acceptor disaccharide LacNAc. Understanding sialyltransferases at the molecular and structural level shed light into their function. We present here two human ST6Gal I structures, which show for the first time the enzyme in the unliganded state and with the full donor substrate CMP-Neu5Ac bound. Comparison of these structures reveal flexibility of the catalytic loop, since in the unliganded structure Tyr354 adopts a conformation seen also as an alternate conformation in the substrate bound structure. CMP-Neu5Ac is bound with the side chain at C5 of the sugar residue directed outwards at the surface of the protein. Furthermore, the exact binding mode of the sialic acid moiety of the substrate directly involves sialylmotifs L, S and III and positions the sialylmotif VS in the immediate vicinity. We also present a model for the ternary complex of ST6Gal I with both the donor and the acceptor substrates.
中文翻译:

高分辨率下人α-2,6-唾液酸转移酶ST6Gal I的未配体和CMP-Neu5Ac结合结构
在细胞表面糖蛋白和糖脂的各种类型的聚糖链中作为末端单糖发现的唾液酸残基已被确定为正常与异常细胞行为中细胞间相互作用的重要贡献者,并且在癌症等疾病中起着关键作用。在脊椎动物中,唾液酸通过具有不同酶促和底物特异性的唾液酸转移酶的保守子集连接到聚糖链上。ST6Gal I 是一种唾液酸转移酶,使用活化的 CMP-唾液酸作为供体底物,催化唾液酸残基和受体双糖 LacNAc 之间形成 α2,6-糖苷键。在分子和结构水平上了解唾液酸转移酶有助于了解它们的功能。我们在这里展示了两个人类 ST6Gal I 结构,这首次显示了未配体状态下的酶与完整的供体底物 CMP-Neu5Ac 结合。这些结构的比较揭示了催化环的灵活性,因为在未配体结构中 Tyr354 采用的构象也被视为底物结合结构中的替代构象。CMP-Neu5Ac 与位于蛋白质表面的糖残基 C5 处的侧链结合。此外,底物唾液酸部分的精确结合模式直接涉及唾液酸基团 L、S 和 III,并将唾液酸基团 VS 定位在紧邻的位置。我们还提出了 ST6Gal I 三元复合物与供体和受体底物的模型。这些结构的比较揭示了催化环的灵活性,因为在未配体结构中 Tyr354 采用的构象也被视为底物结合结构中的替代构象。CMP-Neu5Ac 与位于蛋白质表面的糖残基 C5 处的侧链结合。此外,底物唾液酸部分的精确结合模式直接涉及唾液酸基团 L、S 和 III,并将唾液酸基团 VS 定位在紧邻的位置。我们还提出了 ST6Gal I 三元复合物与供体和受体底物的模型。这些结构的比较揭示了催化环的灵活性,因为在未配体结构中 Tyr354 采用的构象也被视为底物结合结构中的替代构象。CMP-Neu5Ac 与位于蛋白质表面的糖残基 C5 处的侧链结合。此外,底物唾液酸部分的精确结合模式直接涉及唾液酸基团 L、S 和 III,并将唾液酸基团 VS 定位在紧邻的位置。我们还提出了 ST6Gal I 三元复合物与供体和受体底物的模型。CMP-Neu5Ac 与位于蛋白质表面的糖残基 C5 处的侧链结合。此外,底物唾液酸部分的精确结合模式直接涉及唾液酸基团 L、S 和 III,并将唾液酸基团 VS 定位在紧邻的位置。我们还提出了 ST6Gal I 三元复合物与供体和受体底物的模型。CMP-Neu5Ac 与位于蛋白质表面的糖残基 C5 处的侧链结合。此外,底物唾液酸部分的精确结合模式直接涉及唾液酸基元 L、S 和 III,并将唾液酸基元 VS 定位在紧邻的位置。我们还提出了 ST6Gal I 三元复合物与供体和受体底物的模型。











































 京公网安备 11010802027423号
京公网安备 11010802027423号