当前位置:
X-MOL 学术
›
Aging Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A germ cell-specific ageing pattern in otherwise healthy men.
Aging Cell ( IF 8.0 ) Pub Date : 2020-09-20 , DOI: 10.1111/acel.13242 Sandra Laurentino 1 , Jann-Frederik Cremers 1 , Bernhard Horsthemke 2 , Frank Tüttelmann 3 , Karen Czeloth 1 , Michael Zitzmann 1 , Eva Pohl 4 , Sven Rahmann 5 , Christopher Schröder 5 , Sven Berres 1 , Klaus Redmann 1 , Claudia Krallmann 1 , Stefan Schlatt 1 , Sabine Kliesch 1 , Jörg Gromoll 1
Aging Cell ( IF 8.0 ) Pub Date : 2020-09-20 , DOI: 10.1111/acel.13242 Sandra Laurentino 1 , Jann-Frederik Cremers 1 , Bernhard Horsthemke 2 , Frank Tüttelmann 3 , Karen Czeloth 1 , Michael Zitzmann 1 , Eva Pohl 4 , Sven Rahmann 5 , Christopher Schröder 5 , Sven Berres 1 , Klaus Redmann 1 , Claudia Krallmann 1 , Stefan Schlatt 1 , Sabine Kliesch 1 , Jörg Gromoll 1
Affiliation
|
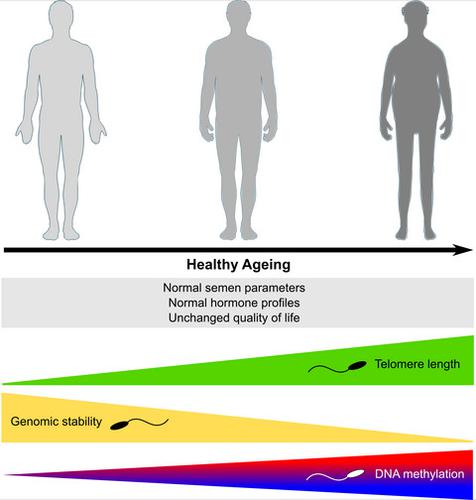
Life‐long sperm production leads to the assumption that male fecundity remains unchanged throughout life. However, recently it was shown that paternal age has profound consequences for male fertility and offspring health. Paternal age effects are caused by an accumulation of germ cell mutations over time, causing severe congenital diseases. Apart from these well‐described cases, molecular patterns of ageing in germ cells and their impact on DNA integrity have not been studied in detail. In this study, we aimed to assess the effects of ‘pure’ ageing on male reproductive health and germ cell quality. We assembled a cohort of 198 healthy men (18–84 years) for which end points such as semen and hormone profiles, sexual health and well‐being, and sperm DNA parameters were evaluated. Sperm production and hormonal profiles were maintained at physiological levels over a period of six decades. In contrast, we identified a germ cell‐specific ageing pattern characterized by a steady increase of telomere length in sperm and a sharp increase in sperm DNA instability, particularly after the sixth decade. Importantly, we found sperm DNA methylation changes in 236 regions, mostly nearby genes associated with neuronal development. By in silico analysis, we found that 10 of these regions are located in loci which can potentially escape the first wave of genome‐wide demethylation after fertilization. In conclusion, human male germ cells present a unique germline‐specific ageing process, which likely results in diminished fecundity in elderly men and poorer health prognosis for their offspring.
中文翻译:

健康男性的生殖细胞特异性衰老模式。
终生精子产生导致男性生育能力终生保持不变的假设。然而,最近表明,父亲年龄对男性生育能力和后代健康有着深远的影响。父亲年龄效应是由生殖细胞突变随着时间的推移积累引起的,会导致严重的先天性疾病。除了这些充分描述的案例之外,还没有详细研究生殖细胞衰老的分子模式及其对 DNA 完整性的影响。在这项研究中,我们旨在评估“纯”衰老对男性生殖健康和生殖细胞质量的影响。我们收集了 198 名健康男性(18-84 岁)的队列,他们评估了精液和激素特征、性健康和幸福以及精子 DNA 参数等终点。精子产生和荷尔蒙水平在 60 年的时间里保持在生理水平。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。我们确定了一种生殖细胞特定的衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,特别是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。我们确定了一种生殖细胞特定的衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。
更新日期:2020-10-23
中文翻译:

健康男性的生殖细胞特异性衰老模式。
终生精子产生导致男性生育能力终生保持不变的假设。然而,最近表明,父亲年龄对男性生育能力和后代健康有着深远的影响。父亲年龄效应是由生殖细胞突变随着时间的推移积累引起的,会导致严重的先天性疾病。除了这些充分描述的案例之外,还没有详细研究生殖细胞衰老的分子模式及其对 DNA 完整性的影响。在这项研究中,我们旨在评估“纯”衰老对男性生殖健康和生殖细胞质量的影响。我们收集了 198 名健康男性(18-84 岁)的队列,他们评估了精液和激素特征、性健康和幸福以及精子 DNA 参数等终点。精子产生和荷尔蒙水平在 60 年的时间里保持在生理水平。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。相比之下,我们发现了一种生殖细胞特异性衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。我们确定了一种生殖细胞特定的衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,特别是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。我们确定了一种生殖细胞特定的衰老模式,其特征是精子中端粒长度的稳定增加和精子 DNA 不稳定性的急剧增加,尤其是在 60 岁之后。重要的是,我们发现精子 DNA 甲基化在 236 个区域发生变化,主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。主要是附近与神经元发育相关的基因。通过计算机分析,我们发现这些区域中有 10 个位于基因座中,这些基因座可能会在受精后逃脱第一波全基因组去甲基化。总之,人类男性生殖细胞呈现出独特的种系特异性衰老过程,这可能会导致老年男性生育力下降和后代健康预后较差。











































 京公网安备 11010802027423号
京公网安备 11010802027423号