当前位置:
X-MOL 学术
›
Nano Today
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Intranasal exposure to ZnO nanoparticles induces alterations in cholinergic neurotransmission in rat brain
Nano Today ( IF 13.2 ) Pub Date : 2020-12-01 , DOI: 10.1016/j.nantod.2020.100977 Zhiling Guo , Peng Zhang , Yali Luo , Heidi Qunhui Xie , Swaroop Chakraborty , Fazel Abdolahpur Monikh , Lijing Bu , Yiyun Liu , Yongchao Ma , Zhiyong Zhang , Eugenia Valsami-Jones , Bin Zhao , Iseult Lynch
Nano Today ( IF 13.2 ) Pub Date : 2020-12-01 , DOI: 10.1016/j.nantod.2020.100977 Zhiling Guo , Peng Zhang , Yali Luo , Heidi Qunhui Xie , Swaroop Chakraborty , Fazel Abdolahpur Monikh , Lijing Bu , Yiyun Liu , Yongchao Ma , Zhiyong Zhang , Eugenia Valsami-Jones , Bin Zhao , Iseult Lynch
|
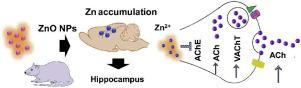
Abstract The neurotoxicity of inhaled ZnO nanoparticles (NPs) and the underlying mechanisms remain largely unknown. In this study, ZnO NPs (30 ± 6 nm) were intranasally instilled to rats via a single dose (13 mg Zn/kg BW), with ZnSO4 as the ionic control, and analysis 7-days post exposure. The hippocampus was found to be the main target for Zn accumulation for both ZnO NPs and ZnSO4. Synchrotron radiation based X-ray absorption fine structure (XAFS) analysis showed that no particulate ZnO was found, suggesting the occurrence of dissolution and transformation of ZnO NPs. Multi-omics analysis, including transcriptomics, proteomics and metabolomics, demonstrated that cholinergic neurotransmission was the main biological process affected following both treatments. The release of the key neurotransmitter acetylcholine (ACh) was increased by enhanced ACh synthesis, upregulation of vesicular ACh transporter, and suppression of the activity of ACh hydrolysis enzyme (AChE), either by direct Zn-AChE interaction or a transcriptional down-regulation mechanism. In addition, ZnO NPs and ZnSO4 induced similar molecular consequences and exhibited the same Zn chemical speciation (100 % of Zn complexes) in the hippocampal region evidenced by XAFS analysis, suggesting that the observed biological effects were mainly derived from Zn2+ released from the ZnO NPs. This study not only evidences a new pathway for the impact of ZnO NPs on the brain, but also identifies the origin of the impact as ionic Zn, which provides the basis for safe-by-design of ZnO NPs.
中文翻译:

鼻内暴露于氧化锌纳米颗粒诱导大鼠脑胆碱能神经传递的改变
摘要 吸入氧化锌纳米颗粒 (NPs) 的神经毒性及其潜在机制在很大程度上仍是未知的。在这项研究中,ZnO NPs (30 ± 6 nm) 通过单剂量 (13 mg Zn/kg BW) 鼻内滴注给大鼠,以 ZnSO4 作为离子对照,并在暴露后 7 天进行分析。发现海马是 ZnO NPs 和 ZnSO4 Zn 积累的主要目标。基于同步辐射的 X 射线吸收精细结构 (XAFS) 分析表明没有发现颗粒状 ZnO,表明发生了 ZnO NPs 的溶解和转化。多组学分析,包括转录组学、蛋白质组学和代谢组学,表明胆碱能神经传递是两种治疗后受影响的主要生物过程。通过增强 ACh 合成、上调囊泡 ACh 转运蛋白和抑制 ACh 水解酶 (AChE) 的活性,通过直接的 Zn-AChE 相互作用或转录下调机制,增加了关键神经递质乙酰胆碱 (ACh) 的释放. 此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。通过直接的 Zn-AChE 相互作用或转录下调机制抑制 ACh 水解酶 (AChE) 的活性。此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了相似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。通过直接的 Zn-AChE 相互作用或转录下调机制抑制 ACh 水解酶 (AChE) 的活性。此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了相似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+。该研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还将影响的起源确定为离子 Zn,这为 ZnO NPs 的安全设计提供了基础。XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+。这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。
更新日期:2020-12-01
中文翻译:

鼻内暴露于氧化锌纳米颗粒诱导大鼠脑胆碱能神经传递的改变
摘要 吸入氧化锌纳米颗粒 (NPs) 的神经毒性及其潜在机制在很大程度上仍是未知的。在这项研究中,ZnO NPs (30 ± 6 nm) 通过单剂量 (13 mg Zn/kg BW) 鼻内滴注给大鼠,以 ZnSO4 作为离子对照,并在暴露后 7 天进行分析。发现海马是 ZnO NPs 和 ZnSO4 Zn 积累的主要目标。基于同步辐射的 X 射线吸收精细结构 (XAFS) 分析表明没有发现颗粒状 ZnO,表明发生了 ZnO NPs 的溶解和转化。多组学分析,包括转录组学、蛋白质组学和代谢组学,表明胆碱能神经传递是两种治疗后受影响的主要生物过程。通过增强 ACh 合成、上调囊泡 ACh 转运蛋白和抑制 ACh 水解酶 (AChE) 的活性,通过直接的 Zn-AChE 相互作用或转录下调机制,增加了关键神经递质乙酰胆碱 (ACh) 的释放. 此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。通过直接的 Zn-AChE 相互作用或转录下调机制抑制 ACh 水解酶 (AChE) 的活性。此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了相似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。通过直接的 Zn-AChE 相互作用或转录下调机制抑制 ACh 水解酶 (AChE) 的活性。此外,通过 XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了相似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+ . 这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+。该研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还将影响的起源确定为离子 Zn,这为 ZnO NPs 的安全设计提供了基础。XAFS 分析证明,ZnO NPs 和 ZnSO4 诱导了类似的分子结果,并在海马区表现出相同的 Zn 化学形态(100% 的 Zn 复合物),表明观察到的生物效应主要来自 ZnO NPs 释放的 Zn2+。这项研究不仅证明了 ZnO NPs 对大脑影响的新途径,而且还确定了影响的起源是离子 Zn,这为 ZnO NPs 的安全设计提供了基础。











































 京公网安备 11010802027423号
京公网安备 11010802027423号