Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Genetic evidence for an inhibitory role of tomosyn in insulin-stimulated GLUT4 exocytosis.
Traffic ( IF 3.6 ) Pub Date : 2020-08-27 , DOI: 10.1111/tra.12760 Shifeng Wang 1, 2 , Yinghui Liu 1 , Lauren Crisman 1 , Chun Wan 1 , Jessica Miller 1 , Haijia Yu 1 , Jingshi Shen 1
Traffic ( IF 3.6 ) Pub Date : 2020-08-27 , DOI: 10.1111/tra.12760 Shifeng Wang 1, 2 , Yinghui Liu 1 , Lauren Crisman 1 , Chun Wan 1 , Jessica Miller 1 , Haijia Yu 1 , Jingshi Shen 1
Affiliation
|
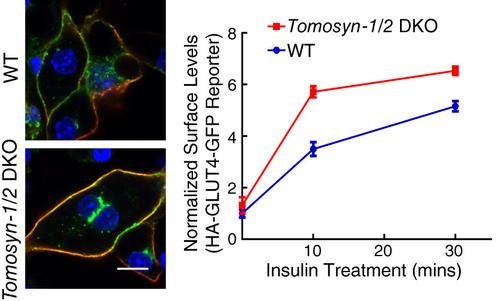
Exocytosis is a vesicle fusion process driven by soluble N‐ethylmaleimide‐sensitive factor attachment protein receptors (SNAREs). A classic exocytic pathway is insulin‐stimulated translocation of the glucose transporter type 4 (GLUT4) from intracellular vesicles to the plasma membrane in adipocytes and skeletal muscles. The GLUT4 exocytic pathway plays a central role in maintaining blood glucose homeostasis and is compromised in insulin resistance and type 2 diabetes. A candidate regulator of GLUT4 exocytosis is tomosyn, a soluble protein expressed in adipocytes. Tomosyn directly binds to GLUT4 exocytic SNAREs in vitro but its role in GLUT4 exocytosis was unknown. In this work, we used CRISPR‐Cas9 genome editing to delete the two tomosyn‐encoding genes in adipocytes. We observed that both basal and insulin‐stimulated GLUT4 exocytosis was markedly elevated in the double knockout (DKO) cells. By contrast, adipocyte differentiation and insulin signaling remained intact in the DKO adipocytes. In a reconstituted liposome fusion assay, tomosyn inhibited all the SNARE complexes underlying GLUT4 exocytosis. The inhibitory activity of tomosyn was relieved by NSF and α‐SNAP, which act in concert to remove tomosyn from GLUT4 exocytic SNAREs. Together, these studies revealed an inhibitory role for tomosyn in insulin‐stimulated GLUT4 exocytosis in adipocytes. We suggest that tomosyn‐arrested SNAREs represent a reservoir of fusion capacity that could be harnessed to treat patients with insulin resistance and type 2 diabetes.
中文翻译:

tomosyn 在胰岛素刺激的 GLUT4 胞吐中的抑制作用的遗传证据。
胞吐作用是由可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体 (SNAREs) 驱动的囊泡融合过程。经典的胞吐途径是胰岛素刺激的 4 型葡萄糖转运蛋白 (GLUT4) 从细胞内囊泡转移到脂肪细胞和骨骼肌中的质膜。GLUT4 胞吐途径在维持血糖稳态中起核心作用,并在胰岛素抵抗和 2 型糖尿病中受到损害。GLUT4 胞吐作用的候选调节剂是tomosyn,一种在脂肪细胞中表达的可溶性蛋白。Tomosyn 在体外直接与 GLUT4 胞吐 SNARE 结合,但其在 GLUT4 胞吐中的作用尚不清楚。在这项工作中,我们使用 CRISPR-Cas9 基因组编辑来删除脂肪细胞中的两个 tomosyn 编码基因。我们观察到双敲除 (DKO) 细胞中基础和胰岛素刺激的 GLUT4 胞吐作用均显着升高。相比之下,DKO 脂肪细胞中的脂肪细胞分化和胰岛素信号传导保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。脂肪细胞分化和胰岛素信号在 DKO 脂肪细胞中保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。脂肪细胞分化和胰岛素信号在 DKO 脂肪细胞中保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。它们协同作用以从 GLUT4 胞外 SNARE 中去除tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。它们协同作用以从 GLUT4 胞外 SNARE 中去除tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。
更新日期:2020-09-25
中文翻译:

tomosyn 在胰岛素刺激的 GLUT4 胞吐中的抑制作用的遗传证据。
胞吐作用是由可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体 (SNAREs) 驱动的囊泡融合过程。经典的胞吐途径是胰岛素刺激的 4 型葡萄糖转运蛋白 (GLUT4) 从细胞内囊泡转移到脂肪细胞和骨骼肌中的质膜。GLUT4 胞吐途径在维持血糖稳态中起核心作用,并在胰岛素抵抗和 2 型糖尿病中受到损害。GLUT4 胞吐作用的候选调节剂是tomosyn,一种在脂肪细胞中表达的可溶性蛋白。Tomosyn 在体外直接与 GLUT4 胞吐 SNARE 结合,但其在 GLUT4 胞吐中的作用尚不清楚。在这项工作中,我们使用 CRISPR-Cas9 基因组编辑来删除脂肪细胞中的两个 tomosyn 编码基因。我们观察到双敲除 (DKO) 细胞中基础和胰岛素刺激的 GLUT4 胞吐作用均显着升高。相比之下,DKO 脂肪细胞中的脂肪细胞分化和胰岛素信号传导保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。脂肪细胞分化和胰岛素信号在 DKO 脂肪细胞中保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。脂肪细胞分化和胰岛素信号在 DKO 脂肪细胞中保持完整。在重组脂质体融合试验中,tomosyn 抑制了 GLUT4 胞吐作用的所有 SNARE 复合物。NSF 和 α-SNAP 减轻了 tomosyn 的抑制活性,它们协同作用从 GLUT4 胞外 SNARE 中去除 tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。它们协同作用以从 GLUT4 胞外 SNARE 中去除tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。它们协同作用以从 GLUT4 胞外 SNARE 中去除tomosyn。总之,这些研究揭示了 tomosyn 在胰岛素刺激的脂肪细胞 GLUT4 胞吐中的抑制作用。我们认为,tomosyn 阻滞的 SNARE 代表了一个融合能力的储存库,可用于治疗胰岛素抵抗和 2 型糖尿病患者。











































 京公网安备 11010802027423号
京公网安备 11010802027423号