当前位置:
X-MOL 学术
›
Chem. Res. Toxicol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Hepatotoxicity of Cadmium Telluride Quantum Dots Induced by Mitochondrial Dysfunction.
Chemical Research in Toxicology ( IF 4.1 ) Pub Date : 2020-08-26 , DOI: 10.1021/acs.chemrestox.9b00526 Kathy C Nguyen 1, 2 , Yan Zhang 1 , Julie Todd 3 , Kevin Kittle 3 , Michelle Lalande 3 , Scott Smith 3 , Douglas Parks 3 , Martha Navarro 3 , Azam F Tayabali 1, 2 , William G Willmore 2
Chemical Research in Toxicology ( IF 4.1 ) Pub Date : 2020-08-26 , DOI: 10.1021/acs.chemrestox.9b00526 Kathy C Nguyen 1, 2 , Yan Zhang 1 , Julie Todd 3 , Kevin Kittle 3 , Michelle Lalande 3 , Scott Smith 3 , Douglas Parks 3 , Martha Navarro 3 , Azam F Tayabali 1, 2 , William G Willmore 2
Affiliation
|
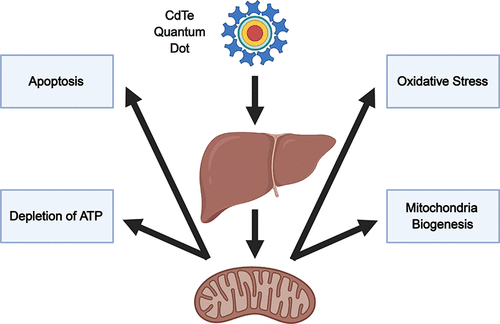
The aim of this study was to investigate the detailed mechanisms of hepatotoxicity induced by cadmium telluride quantum dots (CdTe-QDs) in BALB/c mice after intravenous injection. The study investigated oxidative stress, apoptosis, and effects on mitochondria as potential mechanistic events to elucidate the observed hepatotoxicity. Oxidative stress in the liver, induced by CdTe-QD exposure, was demonstrated by depletion of total glutathione, an increase in superoxide dismutase activity, and changes in the gene expression of several oxidative stress-related biomarkers. Furthermore, CdTe-QD treatment led to apoptosis in the liver via both intrinsic and extrinsic apoptotic pathways. Effects on mitochondria were evidenced by the enlargement and increase in the number of mitochondria in hepatocytes of treated mice. CdTe-QDs also caused changes in the levels and gene expression of electron transport chain enzymes, depletion of ATP, and an increase in the level of the peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1α), a regulator of mitochondrial biogenesis. The findings from this study suggest that CdTe-QDs-induced hepatotoxicity might have originated from mitochondrial effects which resulted in oxidative stress and apoptosis in the liver cells. This study provides insight into the biological effects of CdT-QDs at the tissue level and the detailed mechanisms of their toxicity in animals. The study also provides important data for bridging the gap between in vitro and in vivo testing and risk assessment of these NPs.
中文翻译:

线粒体功能障碍引起的碲化镉量子点的肝毒性。
本研究的目的是研究碲化镉量子点 (CdTe-QDs) 对 BALB/c 小鼠静脉注射后肝毒性的详细机制。该研究调查了氧化应激、细胞凋亡和对线粒体的影响,作为阐明观察到的肝毒性的潜在机制事件。由 CdTe-QD 暴露诱导的肝脏氧化应激通过总谷胱甘肽的消耗、超氧化物歧化酶活性的增加以及几种氧化应激相关生物标志物的基因表达的变化来证明。此外,CdTe-QD 治疗通过内在和外在凋亡途径导致肝脏凋亡。对线粒体的影响通过治疗小鼠肝细胞中线粒体的扩大和数量增加来证明。CdTe-QD 还引起电子传递链酶的水平和基因表达的变化、ATP 的消耗以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 的水平增加,这是线粒体的调节剂。生物发生。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 水平的增加,这是线粒体生物发生的调节剂。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 水平的增加,这是线粒体生物发生的调节剂。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这些纳米颗粒的体外和体内测试和风险评估。
更新日期:2020-09-21
中文翻译:

线粒体功能障碍引起的碲化镉量子点的肝毒性。
本研究的目的是研究碲化镉量子点 (CdTe-QDs) 对 BALB/c 小鼠静脉注射后肝毒性的详细机制。该研究调查了氧化应激、细胞凋亡和对线粒体的影响,作为阐明观察到的肝毒性的潜在机制事件。由 CdTe-QD 暴露诱导的肝脏氧化应激通过总谷胱甘肽的消耗、超氧化物歧化酶活性的增加以及几种氧化应激相关生物标志物的基因表达的变化来证明。此外,CdTe-QD 治疗通过内在和外在凋亡途径导致肝脏凋亡。对线粒体的影响通过治疗小鼠肝细胞中线粒体的扩大和数量增加来证明。CdTe-QD 还引起电子传递链酶的水平和基因表达的变化、ATP 的消耗以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 的水平增加,这是线粒体的调节剂。生物发生。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 水平的增加,这是线粒体生物发生的调节剂。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。以及过氧化物酶体增殖物激活受体 γ 共激活因子 1-α (PGC-1α) 水平的增加,这是线粒体生物发生的调节剂。这项研究的结果表明,CdTe-QDs 诱导的肝毒性可能源于线粒体效应,导致肝细胞氧化应激和细胞凋亡。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这项研究提供了对 CdT-QD 在组织水平上的生物学效应及其在动物中毒性的详细机制的深入了解。该研究还为弥合两者之间的差距提供了重要数据。这些纳米颗粒的体外和体内测试和风险评估。



























 京公网安备 11010802027423号
京公网安备 11010802027423号