Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Biomimicking Fiber Platform with Tunable Stiffness to Study Mechanotransduction Reveals Stiffness Enhances Oligodendrocyte Differentiation but Impedes Myelination through YAP-Dependent Regulation.
Small ( IF 13.0 ) Pub Date : 2020-08-12 , DOI: 10.1002/smll.202003656 William Ong 1, 2 , Nicolas Marinval 1 , Junquan Lin 1 , Mui Hoon Nai 3 , Yee-Song Chong 4, 5 , Coline Pinese 6 , Sreedharan Sajikumar 4, 5 , Chwee Teck Lim 3, 7 , Charles Ffrench-Constant 8 , Marie E Bechler 8, 9 , Sing Yian Chew 1, 10
Small ( IF 13.0 ) Pub Date : 2020-08-12 , DOI: 10.1002/smll.202003656 William Ong 1, 2 , Nicolas Marinval 1 , Junquan Lin 1 , Mui Hoon Nai 3 , Yee-Song Chong 4, 5 , Coline Pinese 6 , Sreedharan Sajikumar 4, 5 , Chwee Teck Lim 3, 7 , Charles Ffrench-Constant 8 , Marie E Bechler 8, 9 , Sing Yian Chew 1, 10
Affiliation
|
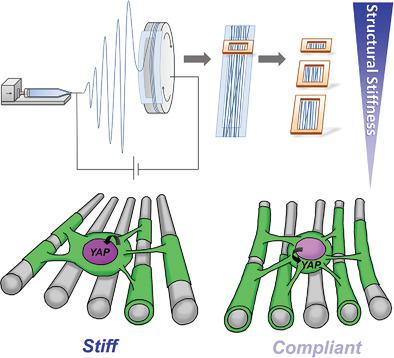
A key hallmark of many diseases, especially those in the central nervous system (CNS), is the change in tissue stiffness due to inflammation and scarring. However, how such changes in microenvironment affect the regenerative process remains poorly understood. Here, a biomimicking fiber platform that provides independent variation of fiber structural and intrinsic stiffness is reported. To demonstrate the functionality of these constructs as a mechanotransduction study platform, these substrates are utilized as artificial axons and the effects of axon structural versus intrinsic stiffness on CNS myelination are independently analyzed. While studies have shown that substrate stiffness affects oligodendrocyte differentiation, the effects of mechanical stiffness on the final functional state of oligodendrocyte (i.e., myelination) has not been shown prior to this. Here, it is demonstrated that a stiff mechanical microenvironment impedes oligodendrocyte myelination, independently and distinctively from oligodendrocyte differentiation. Yes‐associated protein is identified to be involved in influencing oligodendrocyte myelination through mechanotransduction. The opposing effects on oligodendrocyte differentiation and myelination provide important implications for current work screening for promyelinating drugs, since these efforts have focused mainly on promoting oligodendrocyte differentiation. Thus, the platform may have considerable utility as part of a drug discovery program in identifying molecules that promote both differentiation and myelination.
中文翻译:

具有可调节刚度的仿生纤维平台,用于研究机械转导,揭示了刚度可增强少突胶质细胞分化,但可通过YAP依赖性调节来抑制髓鞘形成。
许多疾病(尤其是中枢神经系统(CNS)疾病)的关键特征是由于炎症和疤痕引起的组织僵硬度的变化。但是,这种微环境的变化如何影响再生过程仍然知之甚少。在此,报道了一种仿生纤维平台,该平台提供了纤维结构和固有刚度的独立变化。为证明这些构建体作为机械转导研究平台的功能,将这些底物用作人工轴突,并独立分析了轴突结构与固有刚度对CNS髓鞘形成的影响。虽然研究表明基质刚度会影响少突胶质细胞的分化,但是机械刚度对少突胶质细胞最终功能状态的影响(即 在此之前尚未显示出髓鞘形成。在这里,证明了刚性的机械微环境与少突胶质细胞的分化独立地且显着地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现程序的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。结果表明,僵化的机械微环境与少突胶质细胞的分化独立且明显地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。结果表明,僵化的机械微环境与少突胶质细胞的分化独立且明显地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。
更新日期:2020-09-18
中文翻译:

具有可调节刚度的仿生纤维平台,用于研究机械转导,揭示了刚度可增强少突胶质细胞分化,但可通过YAP依赖性调节来抑制髓鞘形成。
许多疾病(尤其是中枢神经系统(CNS)疾病)的关键特征是由于炎症和疤痕引起的组织僵硬度的变化。但是,这种微环境的变化如何影响再生过程仍然知之甚少。在此,报道了一种仿生纤维平台,该平台提供了纤维结构和固有刚度的独立变化。为证明这些构建体作为机械转导研究平台的功能,将这些底物用作人工轴突,并独立分析了轴突结构与固有刚度对CNS髓鞘形成的影响。虽然研究表明基质刚度会影响少突胶质细胞的分化,但是机械刚度对少突胶质细胞最终功能状态的影响(即 在此之前尚未显示出髓鞘形成。在这里,证明了刚性的机械微环境与少突胶质细胞的分化独立地且显着地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现程序的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。结果表明,僵化的机械微环境与少突胶质细胞的分化独立且明显地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。结果表明,僵化的机械微环境与少突胶质细胞的分化独立且明显地阻碍了少突胶质细胞的髓鞘形成。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。通过机械转导,确定与Yes相关的蛋白参与影响少突胶质细胞的髓鞘形成。由于这些努力主要集中在促进少突胶质细胞的分化,因此对少突胶质细胞的分化和髓鞘化的相反作用为目前的早髓鞘药物的筛选提供了重要的启示。因此,该平台作为药物发现计划的一部分,在识别促进分化和髓鞘形成的分子方面可能具有相当大的实用性。











































 京公网安备 11010802027423号
京公网安备 11010802027423号