当前位置:
X-MOL 学术
›
J. Neurochem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Knockin’ on heaven’s door: Molecular mechanisms of neuronal tau uptake
Journal of Neurochemistry ( IF 4.2 ) Pub Date : 2020-08-08 , DOI: 10.1111/jnc.15144 Samantha De La-Rocque 1, 2 , Edoardo Moretto 1 , Ioana Butnaru 1 , Giampietro Schiavo 1, 2
Journal of Neurochemistry ( IF 4.2 ) Pub Date : 2020-08-08 , DOI: 10.1111/jnc.15144 Samantha De La-Rocque 1, 2 , Edoardo Moretto 1 , Ioana Butnaru 1 , Giampietro Schiavo 1, 2
Affiliation
|
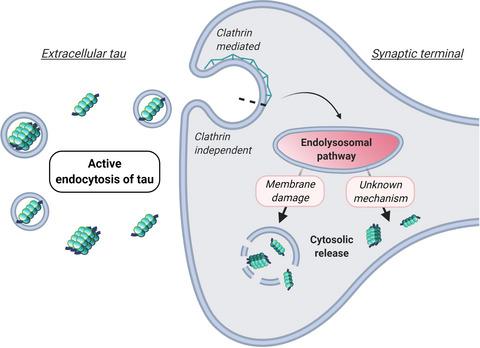
Since aggregates of the microtubule‐binding protein tau were found to be the main component of neurofibrillary tangles more than 30 years ago, their contribution to neurodegeneration in Alzheimer's disease (AD) and tauopathies has become well established. Recent work shows that both tau load and its distribution in the brain of AD patients correlate with cognitive decline more closely compared to amyloid plaque deposition. In addition, the amyloid cascade hypothesis has been recently challenged because of disappointing results of clinical trials designed to treat AD by reducing beta‐amyloid levels, thus fuelling a renewed interest in tau. There is now robust evidence to indicate that tau pathology can spread within the central nervous system via a prion‐like mechanism following a stereotypical pattern, which can be explained by the trans‐synaptic inter‐neuronal transfer of pathological tau. In the receiving neuron, tau has been shown to take multiple routes of internalisation, which are partially dependent on its conformation and aggregation status. Here, we review the emerging mechanisms proposed for the uptake of extracellular tau in neurons and the requirements for the propagation of its pathological conformers, addressing how they gain access to physiological tau monomers in the cytosol. Furthermore, we highlight some of the key mechanistic gaps of the field, which urgently need to be addressed to expand our understanding of tau propagation and lead to the identification of new therapeutic strategies for tauopathies.
中文翻译:

敲开天堂之门:神经元 tau 摄取的分子机制
由于 30 多年前发现微管结合蛋白 tau 的聚集体是神经原纤维缠结的主要成分,因此它们对阿尔茨海默病 (AD) 和 tau 病变的神经退行性变的贡献已得到充分证实。最近的研究表明,与淀粉样蛋白斑块沉积相比,AD 患者大脑中的 tau 负荷及其分布与认知能力下降的相关性更密切。此外,淀粉样蛋白级联假说最近受到挑战,因为旨在通过降低 β-淀粉样蛋白水平治疗 AD 的临床试验结果令人失望,从而重新激发了对 tau 的兴趣。现在有强有力的证据表明 tau 病理可以通过一种类似朊病毒的机制在中枢神经系统内传播,遵循一种刻板的模式,这可以通过病理性 tau 的跨突触神经元间转移来解释。在接收神经元中,tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。
更新日期:2020-08-08
中文翻译:

敲开天堂之门:神经元 tau 摄取的分子机制
由于 30 多年前发现微管结合蛋白 tau 的聚集体是神经原纤维缠结的主要成分,因此它们对阿尔茨海默病 (AD) 和 tau 病变的神经退行性变的贡献已得到充分证实。最近的研究表明,与淀粉样蛋白斑块沉积相比,AD 患者大脑中的 tau 负荷及其分布与认知能力下降的相关性更密切。此外,淀粉样蛋白级联假说最近受到挑战,因为旨在通过降低 β-淀粉样蛋白水平治疗 AD 的临床试验结果令人失望,从而重新激发了对 tau 的兴趣。现在有强有力的证据表明 tau 病理可以通过一种类似朊病毒的机制在中枢神经系统内传播,遵循一种刻板的模式,这可以通过病理性 tau 的跨突触神经元间转移来解释。在接收神经元中,tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。tau 已被证明采取多种内化途径,这部分取决于其构象和聚集状态。在这里,我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。我们回顾了为神经元中细胞外 tau 的摄取提出的新兴机制及其病理构象异构体传播的要求,解决了它们如何获得细胞质中的生理 tau 单体。此外,我们强调了该领域的一些关键机制空白,迫切需要解决这些空白,以扩大我们对 tau 传播的理解并导致确定 tau 病的新治疗策略。











































 京公网安备 11010802027423号
京公网安备 11010802027423号