当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Aerobic Photocatalytic H2 Production by a [NiFe] hydrogenase Engineered to Place a Silver Nanocluster in the Electron Relay
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-06-24 , DOI: 10.1021/jacs.0c04302 Liyun Zhang 1 , Giorgio Morello 1 , Stephen B Carr 2 , Fraser A Armstrong 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-06-24 , DOI: 10.1021/jacs.0c04302 Liyun Zhang 1 , Giorgio Morello 1 , Stephen B Carr 2 , Fraser A Armstrong 1
Affiliation
|
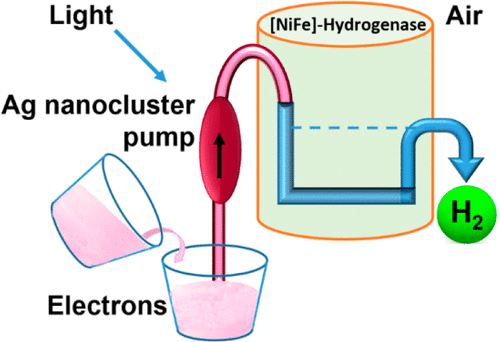
Hydrogenase-1 (Hyd-1) from E. coli poses a conundrum regarding the properties of electrocatalytic reversibility and associated bidirectionality now established for many redox enzymes. Its excellent H2-oxidizing activity begins only once a substantial overpo-tential is applied, and it cannot produce H2. A major reason for its unidirectional behavior is that the reduction potentials of its electron-relaying FeS clusters are too positive relative to the 2H+/H2 couple at neutral pH; consequently, electrons held within the enzyme lack the energy to drive H2 production. However, Hyd-1 is O2-tolerant and even functions in air. Changing a tyrosine (Y) or threonine (T), located on the protein surface within 10 Å of the distal [4Fe-4S] and medial [3Fe-4S] clusters, to cysteine (C), allows site-selective attachment of a silver nanocluster (AgNC), the reduced or photoexcited state of which is a powerful reduct-ant. The AgNC provides a new additional redox site, capturing externally-supplied electrons with sufficiently high energy to drive H2 production. Assemblies of Y'227C (or T'225C) with AgNCs/PMAA (PMAA = polymethylacrylate templating several AgNC) are also electroactive for H2 production at a TiO2 electrode. A colloidal system for visible-light photo-H2 generation is made by building the hybrid enzyme into a heterostructure with TiO2 and graphitic carbon nitride (g-C3N4), the resulting scaffold promoting uptake of electrons excited at the AgNC. Each hydrogenase produces 40 molecules of H2 per second and sustains 20% activity in air.
中文翻译:

通过 [NiFe] 氢化酶在电子继电器中放置银纳米团簇的有氧光催化 H2 生产
来自大肠杆菌的 Hydrogenase-1 (Hyd-1) 提出了一个关于电催化可逆性和相关双向性的性质的难题,现在已为许多氧化还原酶建立。其优异的 H2 氧化活性仅在施加大量过电位时才开始,并且不能产生 H2。其单向行为的一个主要原因是其电子中继 FeS 簇的还原电位相对于中性 pH 值下的 2H+/H2 对太正;因此,酶内的电子缺乏驱动 H2 产生的能量。然而,Hyd-1 是耐氧的,甚至在空气中也能发挥作用。将位于远端 [4Fe-4S] 和中间 [3Fe-4S] 簇 10 Å 内的蛋白质表面上的酪氨酸 (Y) 或苏氨酸 (T) 更改为半胱氨酸 (C),允许位点选择性附着银纳米团簇(AgNC),其还原态或光激发态是一种强大的还原剂。AgNC 提供了一个新的额外氧化还原位点,以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。
更新日期:2020-06-24
中文翻译:

通过 [NiFe] 氢化酶在电子继电器中放置银纳米团簇的有氧光催化 H2 生产
来自大肠杆菌的 Hydrogenase-1 (Hyd-1) 提出了一个关于电催化可逆性和相关双向性的性质的难题,现在已为许多氧化还原酶建立。其优异的 H2 氧化活性仅在施加大量过电位时才开始,并且不能产生 H2。其单向行为的一个主要原因是其电子中继 FeS 簇的还原电位相对于中性 pH 值下的 2H+/H2 对太正;因此,酶内的电子缺乏驱动 H2 产生的能量。然而,Hyd-1 是耐氧的,甚至在空气中也能发挥作用。将位于远端 [4Fe-4S] 和中间 [3Fe-4S] 簇 10 Å 内的蛋白质表面上的酪氨酸 (Y) 或苏氨酸 (T) 更改为半胱氨酸 (C),允许位点选择性附着银纳米团簇(AgNC),其还原态或光激发态是一种强大的还原剂。AgNC 提供了一个新的额外氧化还原位点,以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。以足够高的能量捕获外部提供的电子以驱动 H2 的产生。Y'227C(或 T'225C)与 AgNCs/PMAA(PMAA = 聚甲基丙烯酸酯模板化几个 AgNC)的组件对于在 TiO2 电极上产生 H2 也具有电活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。通过将杂化酶构建成具有 TiO2 和石墨氮化碳 (g-C3N4) 的异质结构,可以制备用于产生可见光光 H2 的胶体系统,由此产生的支架促进了在 AgNC 处激发的电子的吸收。每个氢化酶每秒产生 40 个 H2 分子,并在空气中维持 20% 的活性。











































 京公网安备 11010802027423号
京公网安备 11010802027423号