当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Sensitive, Rapid, Robust, and Reproducible Workflow for Host Cell Protein Profiling in Biopharmaceutical Process Development.
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2020-05-25 , DOI: 10.1021/acs.jproteome.0c00252 Jiao Ma 1 , Greg W Kilby 1
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2020-05-25 , DOI: 10.1021/acs.jproteome.0c00252 Jiao Ma 1 , Greg W Kilby 1
Affiliation
|
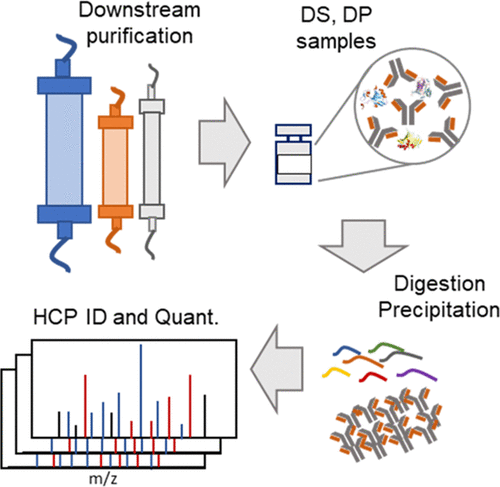
There is a growing industry and regulatory need to detect host cell protein (HCP) impurities in the production of protein biopharmaceuticals, as certain HCPs can impact product stability, safety, and efficacy, even at low levels. In some cases, regulatory agencies require the identification and the quantification of HCPs in drug products (DPs) for risk assessment, and this is an active and growing topic of conversation in the industry and amongst regulators. In this study, we developed a sensitive, robust, and reproducible workflow for HCP detection and quantification in a significantly shorter turnaround time than that previously reported using an Evosep ONE LC system coupled to an Orbitrap Fusion Lumos mass spectrometer. Because of its fast turnaround time, this HCP workflow can be integrated into process development for the high-throughput (60 samples analyzed per day) identification of HCPs. The ability to rapidly measure HCPs and follow their clearance throughout the downstream process can be used to pinpoint sources of HCP contamination, which can be used to optimize biopharmaceutical production to minimize HCP levels. Analysis of the NIST monoclonal antibody reference material using the rapid HCP profiling workflow detected the largest number of HCPs reported to date, underscoring an improvement in performance along with an increased throughput. The HCP workflow can be readily implemented and adapted for different purposes to guide biopharmaceutical process development and enable better risk assessment of HCPs in drug substances and DPs.
中文翻译:

生物制药过程开发中用于宿主细胞蛋白质分析的灵敏,快速,可靠和可重复的工作流程。
在蛋白质生物药物生产中检测宿主细胞蛋白质(HCP)杂质的行业和监管需求不断增长,因为某些HCP甚至在低浓度下也会影响产品的稳定性,安全性和功效。在某些情况下,监管机构要求对药品(DPs)中的HCP进行识别和定量,以进行风险评估,这是业内和监管机构之间不断活跃且不断发展的话题。在这项研究中,我们开发了一种灵敏,稳定且可重现的工作流程,用于HCP检测和定量,与以前使用Evosep ONE LC系统与Orbitrap Fusion Lumos质谱仪联用的报告相比,周转时间短得多。由于周转时间短,该HCP工作流程可以集成到过程开发中,以实现HCP的高通量(每天分析60个样品)的识别。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。
更新日期:2020-05-25
中文翻译:

生物制药过程开发中用于宿主细胞蛋白质分析的灵敏,快速,可靠和可重复的工作流程。
在蛋白质生物药物生产中检测宿主细胞蛋白质(HCP)杂质的行业和监管需求不断增长,因为某些HCP甚至在低浓度下也会影响产品的稳定性,安全性和功效。在某些情况下,监管机构要求对药品(DPs)中的HCP进行识别和定量,以进行风险评估,这是业内和监管机构之间不断活跃且不断发展的话题。在这项研究中,我们开发了一种灵敏,稳定且可重现的工作流程,用于HCP检测和定量,与以前使用Evosep ONE LC系统与Orbitrap Fusion Lumos质谱仪联用的报告相比,周转时间短得多。由于周转时间短,该HCP工作流程可以集成到过程开发中,以实现HCP的高通量(每天分析60个样品)的识别。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。快速测量HCP并跟踪其在整个下游过程中清除的能力可用于查明HCP污染源,可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。可用于优化生物制药生产以最小化HCP水平。使用快速HCP分析工作流程对NIST单克隆抗体参考材料进行的分析检测到迄今为止报道的HCP数量最多,强调了性能的提高以及通量的提高。HCP工作流程可以很容易地实现并适合于不同的目的,以指导生物制药工艺的发展,并能够更好地评估原料药和DP中HCP的风险。











































 京公网安备 11010802027423号
京公网安备 11010802027423号