当前位置:
X-MOL 学术
›
Free Radical Bio. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Zinc and the modulation of Nrf2 in human neuroblastoma cells.
Free Radical Biology and Medicine ( IF 7.1 ) Pub Date : 2020-05-13 , DOI: 10.1016/j.freeradbiomed.2020.05.010 Z Kaufman 1 , G A Salvador 2 , X Liu 1 , P I Oteiza 1
Free Radical Biology and Medicine ( IF 7.1 ) Pub Date : 2020-05-13 , DOI: 10.1016/j.freeradbiomed.2020.05.010 Z Kaufman 1 , G A Salvador 2 , X Liu 1 , P I Oteiza 1
Affiliation
|
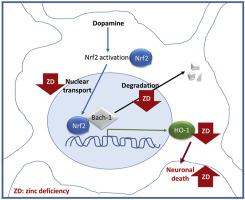
Zinc plays a key role in the modulation of neuronal redox homeostasis. A decreased zinc availability is associated with neuronal NADPH oxidase and nitric oxide synthase activation, deregulation of redox signaling, and impaired glutathione synthesis. The present work tested the hypothesis that zinc is necessary in the neuronal defense response against dopamine (DA)-induced oxidative stress, in particular through heme oxygenase-1 (HO-1) upregulation. DA showed higher cytotoxicity when zinc availability was low. Human IMR-32 neuroblastoma cells responded to high DA concentrations (100 μM) by upregulating HO-1. This upregulation involved Nrf2 translocation to the nucleus, degradation of the Bach-1 repressor, and Nrf2-DNA binding, but it was independent of ERK1/2 activation. DA-mediated induction of HO-1 expression was dependent on the concentration of zinc in the medium. IMR-32 cells incubated in zinc deficient medium showed an impaired response to DA, with lower HO-1 mRNA and protein levels than control DA-challenged cells. This altered HO-1 upregulation was reversed by zinc supplementation. In the presence of DA, Nrf2 nuclear translocation and Bach-1 degradation were lower in zinc deficient cells. The mechanisms involved include: i) impaired Nrf2-tubulin interactions and ii) alterations in the proteasome-mediated degradation of Bach-1 secondary to a decreased ubiquitylation. Results suggest that zinc is crucial in the neuronal response to DA-induced oxidative stress in part through its role in the modulation of the Nrf2-and Bach-1-driven upregulation of HO-1 expression.
中文翻译:

锌和人神经母细胞瘤细胞中 Nrf2 的调节。
锌在调节神经元氧化还原稳态中起关键作用。锌利用率降低与神经元 NADPH 氧化酶和一氧化氮合酶激活、氧化还原信号失调和谷胱甘肽合成受损有关。目前的工作验证了锌在针对多巴胺 (DA) 诱导的氧化应激的神经元防御反应中是必需的假设,特别是通过血红素加氧酶-1 (HO-1) 上调。当锌利用率低时,DA 表现出更高的细胞毒性。人 IMR-32 神经母细胞瘤细胞通过上调 HO-1 对高 DA 浓度 (100 μM) 作出反应。这种上调涉及 Nrf2 易位至细胞核、Bach-1 阻遏物的降解和 Nrf2-DNA 结合,但它与 ERK1/2 激活无关。DA 介导的 HO-1 表达诱导取决于培养基中锌的浓度。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。
更新日期:2020-05-13
中文翻译:

锌和人神经母细胞瘤细胞中 Nrf2 的调节。
锌在调节神经元氧化还原稳态中起关键作用。锌利用率降低与神经元 NADPH 氧化酶和一氧化氮合酶激活、氧化还原信号失调和谷胱甘肽合成受损有关。目前的工作验证了锌在针对多巴胺 (DA) 诱导的氧化应激的神经元防御反应中是必需的假设,特别是通过血红素加氧酶-1 (HO-1) 上调。当锌利用率低时,DA 表现出更高的细胞毒性。人 IMR-32 神经母细胞瘤细胞通过上调 HO-1 对高 DA 浓度 (100 μM) 作出反应。这种上调涉及 Nrf2 易位至细胞核、Bach-1 阻遏物的降解和 Nrf2-DNA 结合,但它与 ERK1/2 激活无关。DA 介导的 HO-1 表达诱导取决于培养基中锌的浓度。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。在缺锌培养基中培养的 IMR-32 细胞显示出对 DA 的反应受损,其 HO-1 mRNA 和蛋白质水平低于对照 DA 攻击细胞。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。这种改变的 HO-1 上调被锌补充剂逆转。在 DA 存在下,Nrf2 核转位和 Bach-1 降解在缺锌细胞中较低。所涉及的机制包括:i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。i) Nrf2-微管蛋白相互作用受损和 ii) 蛋白酶体介导的 Bach-1 降解的改变继发于泛素化降低。结果表明,锌在神经元对 DA 诱导的氧化应激的反应中至关重要,部分原因在于它在调节 Nrf2 和 Bach-1 驱动的 HO-1 表达上调中的作用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号