当前位置:
X-MOL 学术
›
Lett. Appl. Microbiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Engineering CRISPR Interference System to Enhance the Production of Pyrroloquinoline Quinone in Klebsiella pneumoniae
Letters in Applied Microbiology ( IF 2.0 ) Pub Date : 2020-06-04 , DOI: 10.1111/lam.13311 Z Mi 1 , Z Sun 1 , Z Huang 1 , P Zhao 1 , Q Li 2 , P Tian 1
Letters in Applied Microbiology ( IF 2.0 ) Pub Date : 2020-06-04 , DOI: 10.1111/lam.13311 Z Mi 1 , Z Sun 1 , Z Huang 1 , P Zhao 1 , Q Li 2 , P Tian 1
Affiliation
|
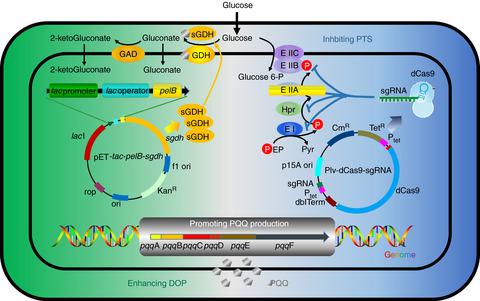
Pyrroloquinoline quinone (PQQ) is a cofactor of glucose dehydrogenase (GDH) and thus participates in glucose utilization. In Klebsiella pneumoniae, glucose utilization involves PQQ-dependent direct oxidation pathway (DOP) and phosphoenolpyruvate-dependent transport system (PTS). It is challenging to overproduce PQQ, as its biosynthesis remains unclear. Here we report that PQQ production can be enhanced by stimulating the metabolic demand for it. First, we developed CRISPR interference (CRISPRi) system to block PTS and thereby intensify DOP. In shake flask cultivation, the strain with CRISPRi system (simultaneously inhibiting four PTS-related genes) produced 225.65 nmol l-1 PQQ, which was 2.14 times that of wild type. In parallel, an exogenous soluble glucose dehydrogenase (sGDH) was overexpressed in K. pneumoniae. In the shake flask cultivation, this sGDH-overexpressing strain accumulated 140.05 nmol l-1 PQQ, which was 1.33 times that of wild type. To combine the above two strategies, we engineered a strain harboring both CRISPRi vector and sGDH-overexpressing vector. In the shake flask cultivation, this two-plasmid strain generated 287.01 nmol l-1 PQQ, which was 2.72 times that of wild type. In bioreactor cultivation, this two-plasmid strain produced 2206.1 nmol l-1 PQQ in 57 h, which was 7.69 times that in shake-flask cultivation. These results indicate that PQQ production can be enhanced by intensifying DOP, as the apo-enzyme GDH is intrinsically coupled with cofactor PQQ. This study provides a strategy for the production of cofactors whose biosynthesis mechanisms remain ambiguous.
中文翻译:

工程化 CRISPR 干扰系统以提高肺炎克雷伯菌中吡咯喹啉醌的产量
吡咯并喹啉醌 (PQQ) 是葡萄糖脱氢酶 (GDH) 的辅助因子,因此参与葡萄糖利用。在肺炎克雷伯菌中,葡萄糖利用涉及 PQQ 依赖性直接氧化途径 (DOP) 和磷酸烯醇丙酮酸依赖性转运系统 (PTS)。过量生产 PQQ 具有挑战性,因为其生物合成仍不清楚。在这里,我们报告可以通过刺激对它的代谢需求来提高 PQQ 的生产。首先,我们开发了 CRISPR 干扰 (CRISPRi) 系统来阻止 PTS,从而加剧 DOP。在摇瓶培养中,具有CRISPRi系统(同时抑制4个PTS相关基因)的菌株产生225.65 nmol l-1 PQQ,是野生型的2.14倍。同时,外源可溶性葡萄糖脱氢酶 (sGDH) 在肺炎克雷伯菌中过度表达。在摇瓶培养中,这种 sGDH 过表达菌株积累了 140.05 nmol l-1 PQQ,是野生型的 1.33 倍。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,辅因子的生物合成机制仍然不明确。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。
更新日期:2020-06-04
中文翻译:

工程化 CRISPR 干扰系统以提高肺炎克雷伯菌中吡咯喹啉醌的产量
吡咯并喹啉醌 (PQQ) 是葡萄糖脱氢酶 (GDH) 的辅助因子,因此参与葡萄糖利用。在肺炎克雷伯菌中,葡萄糖利用涉及 PQQ 依赖性直接氧化途径 (DOP) 和磷酸烯醇丙酮酸依赖性转运系统 (PTS)。过量生产 PQQ 具有挑战性,因为其生物合成仍不清楚。在这里,我们报告可以通过刺激对它的代谢需求来提高 PQQ 的生产。首先,我们开发了 CRISPR 干扰 (CRISPRi) 系统来阻止 PTS,从而加剧 DOP。在摇瓶培养中,具有CRISPRi系统(同时抑制4个PTS相关基因)的菌株产生225.65 nmol l-1 PQQ,是野生型的2.14倍。同时,外源可溶性葡萄糖脱氢酶 (sGDH) 在肺炎克雷伯菌中过度表达。在摇瓶培养中,这种 sGDH 过表达菌株积累了 140.05 nmol l-1 PQQ,是野生型的 1.33 倍。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,辅因子的生物合成机制仍然不明确。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。为了结合上述两种策略,我们设计了一种同时包含 CRISPRi 载体和 sGDH 过表达载体的菌株。在摇瓶培养中,该双质粒菌株产生287.01 nmol l-1 PQQ,是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。是野生型的2.72倍。在生物反应器培养中,该双质粒菌株在57 h内产生2206.1 nmol l-1 PQQ,是摇瓶培养的7.69倍。这些结果表明可以通过加强 DOP 来增强 PQQ 的产生,因为脱辅基酶 GDH 与辅因子 PQQ 内在地偶联。这项研究为生产辅因子提供了一种策略,其生物合成机制仍然不明确。









































 京公网安备 11010802027423号
京公网安备 11010802027423号