当前位置:
X-MOL 学术
›
J. Neuroendocrinol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Obesity and regulation of human placental lactogen production in pregnancy.
Journal of Neuroendocrinology ( IF 3.3 ) Pub Date : 2020-04-26 , DOI: 10.1111/jne.12859 Peter A Cattini 1 , Yan Jin 1 , Jessica S Jarmasz 1 , Noshin Noorjahan 1 , Margaret E Bock 1
Journal of Neuroendocrinology ( IF 3.3 ) Pub Date : 2020-04-26 , DOI: 10.1111/jne.12859 Peter A Cattini 1 , Yan Jin 1 , Jessica S Jarmasz 1 , Noshin Noorjahan 1 , Margaret E Bock 1
Affiliation
|
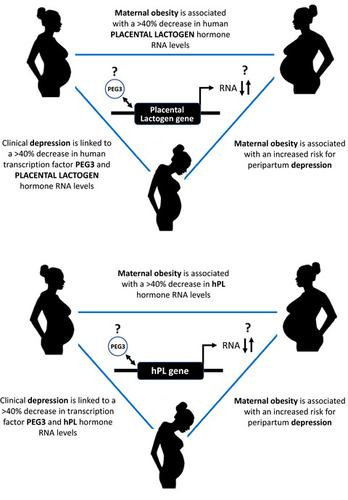
The four genes coding for placental members of the human (h) growth hormone (GH) family include two that code independently for placental lactogen (PL), also known as chorionic somatomammotrophin hormone, one that codes for placental growth hormone (PGH) and a pseudogene for which RNA but no protein product is reported. These genes are expressed preferentially in the villus syncytiotrophoblast of the placenta in pregnancy. In higher primates, the placental members, including hPL and PGH, are the result of multiple duplication events of the GH gene. This contrasts with rodents and ruminants, where PLs result from duplication of the prolactin (PRL) gene. Thus, unlike their mouse counterparts, the hPL and PGH hormones bind both lactogenic and somatogenic receptors with varying affinity. Roles influenced by nutrient availability in both metabolic control in pregnancy and maternal behaviour are supported. However, the effect maternal obesity has on the activation of placental members of the hGH gene family, particularly the expression and function of those genes, is poorly understood. Evidence from partially humanised hGH/PL transgenic mice indicates that both the remote upstream hPL locus control region (LCR) and more gene‐related regulatory regions are required for placental expression in vivo. Furthermore, a specific pattern of interactions between the LCR and hPL gene promoter regions is detected in term placenta chromatin from women with a normal body mass index (BMI) in the range 18.5–25 kg m‐2 by chromosome conformation capture assay. This pattern is disrupted with maternal obesity (class II BMI > 35 kg m‐2) and associated with a > 40% decrease in term hPL RNA levels, as well as serum hPL but not PRL levels, during pregnancy. The relative importance of the chromosomal architecture and predicted properties for transcription factor participation in terms of hPL production and response to obesity are considered, based on comparison with components required for efficient human pituitary GH gene expression.
中文翻译:

肥胖和妊娠期人类胎盘催乳素产生的调节。
编码人类 (h) 生长激素 (GH) 家族胎盘成员的四个基因包括两个独立编码胎盘催乳素 (PL),也称为绒毛膜生长激素激素,一个编码胎盘生长激素 (PGH) 和一个其 RNA 但没有报告蛋白质产物的假基因。这些基因优先在妊娠期胎盘的绒毛合体滋养层中表达。在高等灵长类动物中,胎盘成员,包括 hPL 和 PGH,是 GH 基因多次复制事件的结果。这与啮齿动物和反刍动物形成对比,其中 PLs 是由催乳素 (PRL) 基因的重复产生的。因此,与它们的小鼠对应物不同,hPL 和 PGH 激素以不同的亲和力结合催乳和促生长受体。支持营养供应在妊娠代谢控制和母体行为中的作用。然而,母亲肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能,我们知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 人们对母体肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能的影响知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 人们对母体肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能的影响知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式‐2通过染色体构象捕获测定。这种模式因母亲肥胖(II 类 BMI > 35 kg m ‐2)而被破坏,并且与怀孕期间足月 hPL RNA 水平以及血清 hPL 而非 PRL 水平下降 > 40% 相关。基于与有效人类垂体 GH 基因表达所需的成分的比较,考虑了染色体结构的相对重要性和转录因子参与在 hPL 产生和对肥胖的反应方面的预测特性。
更新日期:2020-04-26
中文翻译:

肥胖和妊娠期人类胎盘催乳素产生的调节。
编码人类 (h) 生长激素 (GH) 家族胎盘成员的四个基因包括两个独立编码胎盘催乳素 (PL),也称为绒毛膜生长激素激素,一个编码胎盘生长激素 (PGH) 和一个其 RNA 但没有报告蛋白质产物的假基因。这些基因优先在妊娠期胎盘的绒毛合体滋养层中表达。在高等灵长类动物中,胎盘成员,包括 hPL 和 PGH,是 GH 基因多次复制事件的结果。这与啮齿动物和反刍动物形成对比,其中 PLs 是由催乳素 (PRL) 基因的重复产生的。因此,与它们的小鼠对应物不同,hPL 和 PGH 激素以不同的亲和力结合催乳和促生长受体。支持营养供应在妊娠代谢控制和母体行为中的作用。然而,母亲肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能,我们知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 人们对母体肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能的影响知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 人们对母体肥胖对 hGH 基因家族胎盘成员激活的影响,特别是这些基因的表达和功能的影响知之甚少。来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式 来自部分人源化 hGH/PL 转基因小鼠的证据表明,体内胎盘表达需要远程上游 hPL 基因座控制区 (LCR) 和更多基因相关的调控区。此外,在正常体重指数 (BMI) 范围为 18.5-25 kg·m 的女性的足月胎盘染色质中检测到 LCR 和 hPL 基因启动子区域之间的特定相互作用模式‐2通过染色体构象捕获测定。这种模式因母亲肥胖(II 类 BMI > 35 kg m ‐2)而被破坏,并且与怀孕期间足月 hPL RNA 水平以及血清 hPL 而非 PRL 水平下降 > 40% 相关。基于与有效人类垂体 GH 基因表达所需的成分的比较,考虑了染色体结构的相对重要性和转录因子参与在 hPL 产生和对肥胖的反应方面的预测特性。











































 京公网安备 11010802027423号
京公网安备 11010802027423号