Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
PLX3397 treatment inhibits constitutive CSF1R-induced oncogenic ERK signaling, reduces tumor growth, and metastatic burden in osteosarcoma
Bone ( IF 3.5 ) Pub Date : 2020-07-01 , DOI: 10.1016/j.bone.2020.115353 Branden A Smeester 1 , Nicholas J Slipek 1 , Emily J Pomeroy 1 , Kanut Laoharawee 1 , Sara H Osum 1 , Alex T Larsson 2 , Kyle B Williams 1 , Natalie Stratton 3 , Kenta Yamamoto 4 , Joseph J Peterson 3 , Susan K Rathe 5 , Lauren J Mills 6 , Wendy A Hudson 5 , Margaret R Crosby 5 , Minjing Wang 1 , Eric P Rahrmann 7 , Branden S Moriarity 1 , David A Largaespada 8
Bone ( IF 3.5 ) Pub Date : 2020-07-01 , DOI: 10.1016/j.bone.2020.115353 Branden A Smeester 1 , Nicholas J Slipek 1 , Emily J Pomeroy 1 , Kanut Laoharawee 1 , Sara H Osum 1 , Alex T Larsson 2 , Kyle B Williams 1 , Natalie Stratton 3 , Kenta Yamamoto 4 , Joseph J Peterson 3 , Susan K Rathe 5 , Lauren J Mills 6 , Wendy A Hudson 5 , Margaret R Crosby 5 , Minjing Wang 1 , Eric P Rahrmann 7 , Branden S Moriarity 1 , David A Largaespada 8
Affiliation
|
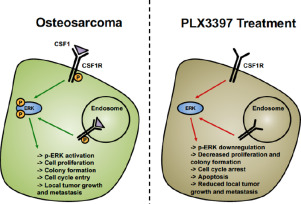
Osteosarcoma (OSA) is a heterogeneous and aggressive solid tumor of the bone. We recently identified the colony stimulating factor 1 receptor (Csf1r) gene as a novel driver of osteosarcomagenesis in mice using the Sleeping Beauty (SB) transposon mutagenesis system. Here, we report that a CSF1R-CSF1 autocrine/paracrine signaling mechanism is constitutively activated in a subset of human OSA cases and is critical for promoting tumor growth and contributes to metastasis. We examined CSF1R and CSF1 expression in OSAs. We utilized gain-of-function and loss-of-function studies (GOF/LOF) to evaluate properties of cellular transformation, downstream signaling, and mechanisms of CSF1R-CSF1 action. Genetic perturbation of CSF1R in immortalized osteoblasts and human OSA cell lines significantly altered oncogenic properties, which were dependent on the CSF1R-CSF1 autocrine/paracrine signaling. These functional alterations were associated with changes in the known CSF1R downstream ERK effector pathway and mitotic cell cycle arrest. We evaluated the recently FDA-approved CSF1R inhibitor Pexidartinib (PLX3397) in OSA cell lines in vitro and in vivo in cell line and patient-derived xenografts. Pharmacological inhibition of CSF1R signaling recapitulated the in vitro genetic alterations. Moreover, in orthotopic OSA cell line and subcutaneous patient-derived xenograft (PDX)-injected mouse models, PLX3397 treatment significantly inhibited local OSA tumor growth and lessened metastatic burden. In summary, CSF1R is utilized by OSA cells to promote tumorigenesis and may represent a new molecular target for therapy.
中文翻译:

PLX3397 治疗抑制组成型 CSF1R 诱导的致癌 ERK 信号传导,减少骨肉瘤的肿瘤生长和转移负担
骨肉瘤 (OSA) 是一种异质性和侵袭性的骨实体瘤。我们最近使用睡美人 (SB) 转座子诱变系统确定了集落刺激因子 1 受体 (Csf1r) 基因作为小鼠骨肉瘤形成的新驱动因素。在这里,我们报告 CSF1R-CSF1 自分泌/旁分泌信号传导机制在人类 OSA 病例的一个子集中被激活,对于促进肿瘤生长和转移至关重要。我们检查了 OSA 中的 CSF1R 和 CSF1 表达。我们利用功能获得和功能丧失研究 (GOF/LOF) 来评估细胞转化、下游信号传导和 CSF1R-CSF1 作用机制的特性。CSF1R 在永生化成骨细胞和人类 OSA 细胞系中的遗传扰动显着改变了致癌特性,这依赖于 CSF1R-CSF1 自分泌/旁分泌信号。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。
更新日期:2020-07-01
中文翻译:

PLX3397 治疗抑制组成型 CSF1R 诱导的致癌 ERK 信号传导,减少骨肉瘤的肿瘤生长和转移负担
骨肉瘤 (OSA) 是一种异质性和侵袭性的骨实体瘤。我们最近使用睡美人 (SB) 转座子诱变系统确定了集落刺激因子 1 受体 (Csf1r) 基因作为小鼠骨肉瘤形成的新驱动因素。在这里,我们报告 CSF1R-CSF1 自分泌/旁分泌信号传导机制在人类 OSA 病例的一个子集中被激活,对于促进肿瘤生长和转移至关重要。我们检查了 OSA 中的 CSF1R 和 CSF1 表达。我们利用功能获得和功能丧失研究 (GOF/LOF) 来评估细胞转化、下游信号传导和 CSF1R-CSF1 作用机制的特性。CSF1R 在永生化成骨细胞和人类 OSA 细胞系中的遗传扰动显着改变了致癌特性,这依赖于 CSF1R-CSF1 自分泌/旁分泌信号。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。这些功能改变与已知的 CSF1R 下游 ERK 效应通路和有丝分裂细胞周期停滞的变化有关。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。我们评估了最近 FDA 批准的 CSF1R 抑制剂 Pexidartinib (PLX3397) 在 OSA 细胞系中的体外和体内细胞系和患者来源的异种移植物。CSF1R信号的药理学抑制概括了体外遗传改变。此外,在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。在原位 OSA 细胞系和皮下患者来源的异种移植物 (PDX) 注射的小鼠模型中,PLX3397 治疗显着抑制了局部 OSA 肿瘤的生长并减轻了转移负担。总之,CSF1R 被 OSA 细胞用于促进肿瘤发生,并可能代表治疗的新分子靶点。











































 京公网安备 11010802027423号
京公网安备 11010802027423号